por zelenne marino 5 anos atrás
808
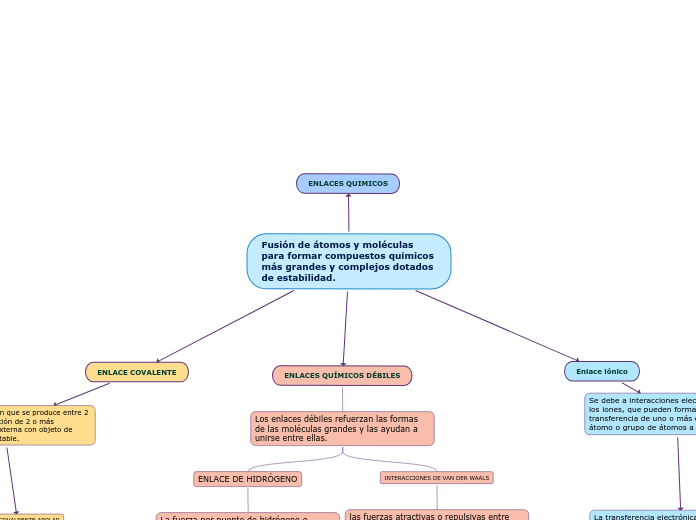
Fusión de átomos y moléculas para formar compuestos químicos más grandes y complejos dotados de estabilidad.
por zelenne marino 5 anos atrás
808

Mais informações
Name the character
Type in the name of the character whose change throughout the story you are going to analyze.
Example: Nick Carraway.
Character's behavior
Think of the character's behavior at the beginning of the story and look for the way it changed throughout the story.
las fuerzas atractivas o repulsivas entre moléculas distintas a aquellas debidas a un enlace intermolecular (enlace iónico, enlace metálico y enlace covalente de tipo reticular) o a la interacción electrostática de iones con moléculas
La fuerza por puente de hidrógeno o enlace de hidrógeno es la fuerza eminentemente electrostática atractiva entre un átomo electronegativo y un átomo de hidrógeno unido covalentemente a otro átomo electronegativo.
Title
Type in the title and author of the literary work that introduces the character.
Example: The Great Gatsby, by F. Scott Fitzgerald.
Se produce cuando ambos átomos disponen de la misma fuerza de atracción de los electrones hacia su mismo núcleo. Los enlaces covalentes apolares siempre se producen cuando el enlace se realiza entre 2 átomos iguales o con el mismo grado de electronegatividad.
El fluoruro de hidrógeno (HF) es un ejemplo de una molécula que tiene un enlace covalente polar. El flúor es el átomo más electronegativo, por lo que los electrones en el enlace están más estrechamente asociado con el átomo de flúor que con el átomo de hidrógeno.
ejemplo: Fluoruros (F-). Sales catódicas obtenidas del ácido fluorhídrico (HF), empleadas en la fabricación de pastas dentales y otros insumos odontológicos.