Legami chimici
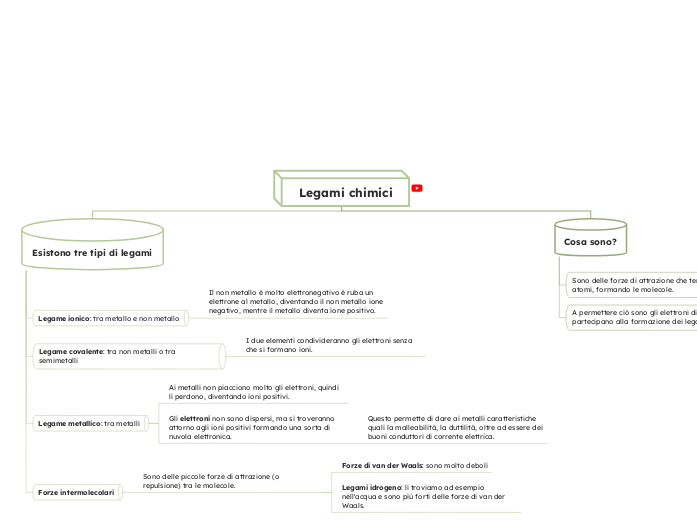
Cosa sono?
A permettere ciò sono gli elettroni di valenza, che partecipano alla formazione dei legami.
Gli elettroni di valenza sono quelli esterni, il cui valore posso ricavalo dal gruppo di appartenenza, scritto in numero romano.
Sono delle forze di attrazione che tengono uniti gli atomi, formando le molecole.
Esistono tre tipi di legami
Forze intermolecolari
Sono delle piccole forze di attrazione (o repulsione) tra le molecole.
Legami idrogeno: li troviamo ad esempio nell'acqua e sono più forti delle forze di van der Waals.
Forze di van der Waals: sono molto deboli
Legame metallico: tra metalli
Gli elettroni non sono dispersi, ma si troveranno attorno agli ioni positivi formando una sorta di nuvola elettronica.
Questo permette di dare ai metalli caratteristiche quali la malleabilità, la duttilità, oltre ad essere dei buoni conduttori di corrente elettrica.
Ai metalli non piacciono molto gli elettroni, quindi li perdono, diventando ioni positivi.
Legame covalente: tra non metalli o tra semimetalli
I due elementi condivideranno gli elettroni senza che si formano ioni.
Legame ionico: tra metallo e non metallo
Il non metallo è molto elettronegativo è ruba un elettrone al metallo, diventando il non metallo ione negativo, mentre il metallo diventa ione positivo.