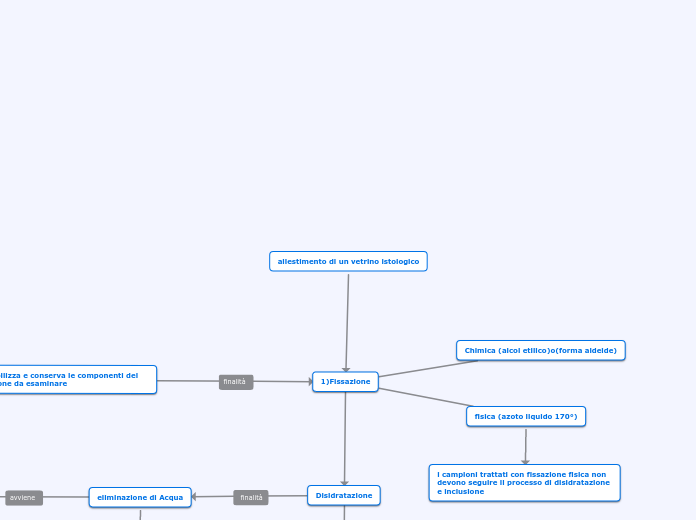
allestimento di un vetrino istologico
1)Fissazione
Chimica (alcol etilico)o(forma aldeide)
fisica (azoto liquido 170°)
i campioni trattati con fissazione fisica non devono seguire il processo di disidratazione e inclusione
Disidratazione
eliminazione di Acqua
poichè un campione contenente acqua ha una consistenza molle e ciò rende più difficile il sezionamento
immergendo il campione in soluzioni di alcol etilico con concentrazioni di alcol sempre maggiori
Diafanizzazione
Rende il campione trasparente
immergendo il campione nello xilolo
solubilizza i lipidi e scioglie l'etanolo
Inclusione
immergendo il campione in una sostanza che è liquida alle alte temperatue e solida alle basse temperature
Paraffina fusa (microscopia ottica)
Resina epossidica(microscopia elettronica)
rende al tessuto la giusta consistenza per ottenere sezioni sottili.
Sezionamento
sezione immersa in Xilolo
rimozione della paraffina
Reidratazione
preparare il campione alla colorazione
ciò favorisce il legame tra il colorante e il campione
taglio del preparato istologico in diverse sezioni avente lo stesso spessore
sezioni :spessore 3-10 micron
microtomo (meccanismo automatico)
Colorazione
I coloranti possono essere suddivisi fondamentalmente in:
coloranti acidi
coloranti basici
coloranti neutri
mordenzanti
le principali colorazioni che vengono utilizzate in istologia per visualizzare particolari componenti tessutali.
EMATOSSILINA – EOSINA
IMPREGNAZIONE ARGENTICA PER LE FIBRE RETICOLARI
COLORAZIONE TRICROMICA