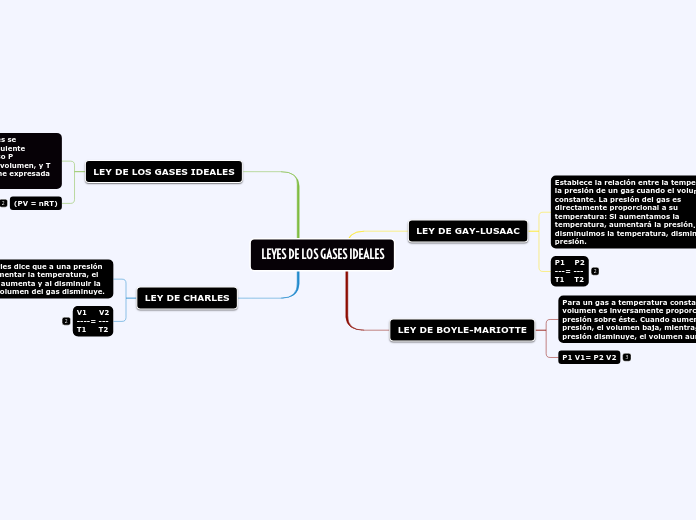
LEYES DE LOS GASES IDEALES
LEY DE GAY-LUSAAC
Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante. La presión del gas es directamente proporcional a su temperatura: Si aumentamos la temperatura, aumentará la presión. Si disminuimos la temperatura, disminuirá la presión.
P1 P2
---= ---
T1 T2
LEY DE BOYLE-MARIOTTE
Para un gas a temperatura constante, el volumen es inversamente proporcional a la presión sobre éste. Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye, el volumen aumenta.
P1 V1= P2 V2
LEY DE LOS GASES IDEALES
La ley general de gases ideales se encuentra formulada de la siguiente manera: PV/T= K. en este caso P representa la presión, V es el volumen, y T es la temperatura, la cual viene expresada en Kelvin.
(PV = nRT)
LEY DE CHARLES
En esta ley, Charles dice que a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura el volumen del gas disminuye.
V1 V2
----= ---
T1 T2