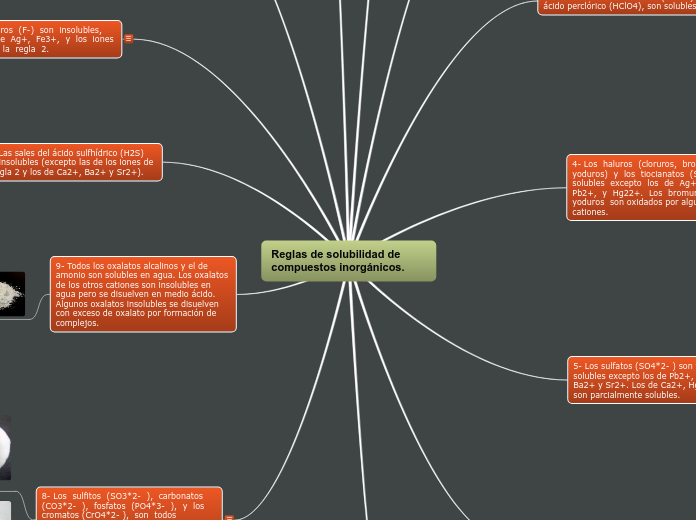
Reglas de solubilidad de compuestos inorgánicos.
1- Todos los nitratos son solubles.

2- Las sales de los cationes del grupo I (sodio, potasio, rubidio y cesio, ha excepción del litio) y del ion amonio son solubles.

3- Las sales del ácido clórico (HClO3) y del ácido perclórico (HClO4), son solubles.

4- Los haluros (cloruros, bromuros y yoduros) y los tiocianatos (SCN-) son solubles excepto los de Ag+, Tl+, Pb2+, y Hg22+. Los bromuros y yoduros son oxidados por algunos cationes.

Tiocianato

Haluros
5- Los sulfatos (SO4*2- ) son todos solubles excepto los de Pb2+, Hg2+ , Ba2+ y Sr2+. Los de Ca2+, Hg22+ y Ag+, son parcialmente solubles.

6- Los nitritos (NO2-) y permanganatos (MnO4- ) son solubles excepto el nitrito de plata (AgNO2).

Permanganato

Nitrito
7- Los tiosulfatos (S2O3*2- ) son solubles, excepto los de Pb2+, Ba2+, y Ag+.6

13- Los hidróxidos (OH-) son insolubles, excepto los de Sr2+, Ba2+, Ca2+ y los de los iones enlistados en la regla 2. .

12- Los ferrocianuros (Fe(CN)6*4-) son insolubles, excepto los de los iones enlistados en la regla 2.

11- Los fluoruros (F-) son insolubles, excepto los de Ag+, Fe3+, y los iones enlistados en la regla 2.

10- Las sales del ácido sulfhídrico (H2S) son insolubles (excepto las de los iones de la regla 2 y los de Ca2+, Ba2+ y Sr2+).

9- Todos los oxalatos alcalinos y el de amonio son solubles en agua. Los oxalatos de los otros cationes son insolubles en agua pero se disuelven en medio ácido. Algunos oxalatos insolubles se disuelven con exceso de oxalato por formación de complejos.

8- Los sulfitos (SO3*2- ), carbonatos (CO3*2- ), fosfatos (PO4*3- ), y los cromatos (CrO4*2- ), son todos insolubles en medio básico o neutro, excepto los de los iones enlistados en la regla 2 (alcalinos y ion amonio).

Sulfito

Carbonato

Cromato