RESPUESTA INMUNOPATOLÓGICA DEL HOSPEDERO

Mecanismos inmunológicos involucrados en los Trasplantes
Rechazo
es la respuesta del organismo al órgano trasplantado a través del sistema inmunitario que es el encargado de protegernos contra las infecciones. Para evitar el rechazo del nuevo órgano, se utilizan los medicamentos inmunosupresores que debilitan la respuesta inmunitaria del organismo.
Histocompatibilidad
La principal característica de estos genes es su elevado polimorfismo; esto es, la presencia de una gran cantidad de variaciones en cada uno de los individuos.
Clasificación de los trasplantes
Autotrasplantes en los que se usan sus propias células sanguíneas o médula ósea
Alotrasplantes en los que se usan las células sanguíneas o médula ósea de un donante. En un isotrasplante, se usan células o médula ósea del gemelo idéntico de la persona.
Mecanismos de respuestainmunológicaal trasplante
Los linfocitos T no presentan constitutivamente HLA de clase II, sino que sólo cuando se activan; los linfocitos B sí lo expresan constitutivamente.
linfocitos B tienen como única función la producción de anticuerpos; tan importante como esta es su función de reconocer y presentar cadenas peptídicas a los linfocitos T. La expresión de moléculas HLA de clase II puede ser inducible prácticamente en todos los tipos celulares.
Función de las citocinas
IL-2
IL-2, porque tiene que ver con el modo de acción de ciclosporina y porque es una citoquina muy importante, pero también es muy importante el interferón gama, fundamentalmente porque permite que los HLA de clase II se expresen en las superficies de las células en que es inducible.
IFN γ
Los linfocitos T CD8 secretan TNF alfa, la linfotoxina, el IFN γ y la IL-1. El TNF alfa también es muy importante, sobre todo porque ahora existe un anticuerpo monoclonal que puede bloquearlo.
IL-4, IL-5, IL-6, IL-9
destinadas a activar la inmunidad humoral, mientras que las primeras están destinadas a actuar sobre los linfocitos T CD8 (los citotóxicos), que tienen la capacidad de actuar directamente al contactar las membranas con su target.
Tipos de rechazo
Hiperagudo
se produce por la existencia de anticuerpos preformados en el paciente receptor contra antígenos HLA del donante.2 Estos anticuerpos se unen a la superficie endotelial del arteriolas del injerto, activan el sistema de complemento y producen una lesión vascular grave, que incluye trombosis y obliteración de la vasculatura del injerto.
Agudo
Los elementos más importantes del rechazo, desde el punto de vista inmunológico, son las células presentadoras de antígenos, que gatillan la activación de linfocitos T CD4 y CD8 y dan lugar a una respuesta mixta local y sistémica. Posteriormente, las citoquinas activan células no específicas que facilitan el desarrollo de células T específicas, natural killer, o citotoxicidad mediada por macrófagos, y finalmente, la destrucción del injerto.
Entre los factores que predisponen al rechazo agudo se cuentan la mala compatibilidad, la subinmunosupresión, la variación en los niveles de ciclosporina y las infecciones virales.
Crónico
Se puede desarrollar en cualquier momento. Para permitir que el órgano
donado se adapte satisfactoriamente a su cuerpo, se debe administrar medicamentos para engañar a su sistema inmunológico a aceptar el trasplante.
Mecanismos inmunológicos del Cáncer
Teoría de la Inmunovigilancia
postula que el sistema inmune es capaz de detectar células cancerosas reconociendo sus características particulares y eliminarlas previniendo
la progresión del cáncer
Inmunoedición del cáncer
Eliminación
es lo mismo inmunovigilancia.
Equilibrio
proceso por el cual el sistema inmune repetitivamente selecciona y promueve la generación de variantes del tumor que pueden resistir a los ataques del sistema inmune.
Escape
es el proceso por el que el tumor que se ha generado durante la fase de equilibrio prolifera de manera incontrolada. Las células tumorales menos inmunogénicas se expanden.
Respuestas inmunitarias
En el sistema innato, las células NK son las principales efectoras siendo una respuesta rápida independiente de antígeno, es decir, inespecífica y donde no hay intervención de células memoria.
el sistema inmune adaptativo genera una respuesta más tardía y específica (depende de la presencia de antígeno) e intervienen células memoria, en concreto los linfocitos T citotóxicos CD8+ (CTLs). La regulación de las células NK se produce por un balance entre las señales de activación en inhibición. Por su parte, la presentación de antígenos unidos a HLA-I es la que regula a los CTLs.
Clasificación de antígenos tumorales
TAA
están relativamente limitados a las células tumorales.
Desarrollo de mutaciones de sentido alterado en varios genes no asociados directamente con un supresor tumoral o con oncogenes y que causa la aparición de neoantígenos específicos del tumor en la superficie celular
TSA
son exclusivos de las células tumorales.
Alteración de oncogenes o genes supresores de tumores por carcinógenos, que conducen a la formación de neoantígenos (una secuencia proteica nueva o la acumulación de proteínas que normalmente no se expresan o que se expresan en muy bajas concentraciones, como ras o p53), sea mediante la generación directa de una nueva secuencia de proteínas o la inducción de la acumulación de estas proteínas
Inmunopatología
Cáncer de mama
La baja inmunogenicidad de estos tumores se debe a varios factores entre los que se encuentran: la expresión heterogénea de antígenos dentro del tumor primario o en sus metástasis, las modificaciones del perfil antigénico durante la progresión del tumor, los niveles bajos de expresión del complejo principal de histocompatibilidad (MHC/ del inglés: major histocompatibility complex) y las citocinas supresoras liberadas.
La expresión de moléculas responsables de los lazos regulatorios que bloquean la activación T, como por ejemplo: el antígeno 4 asociado a linfocitos T citotóxicos (CTLA-4/ del inglés: cytotoxic T lymphocyte-associated antigen 4) y la molécula 1 de muerte programada (PD-1/ del inglés: programmed death-1); las cuales pueden actuar como factores inmunosupresores a nivel del microambiente del tumor, lo que favorece la evasión del tumor de la posible acción citotóxica de la respuesta inmune
Cáncer de próstata
Las células cancerígenas prostáticas expresan varios antígenos asociados a tumores que están siendo evaluados actualmente como dianas para abordajes de inmunoterapia activa y específica. Las células dendríticas son las células presentadoras de antígenos más potentes, capaces de activar las células T vírgenes y romper la tolerancia periférica, y así inducir respuestas inmunes a tumores.

Inmunizaciones
PASIVA y ACTIVA
Activa: Es la protección producida
por el propio sistema inmunológico de las personas, generalmente es permanente.
Pasiva: Protección obtenida a través de la transferencia de anticuerpos humanos o de animales. Genera una resistencia rápida sin que se ponga en marcha una respuesta inmunitaria activa. La protección es temporal y puede durar semanas o meses.
Antígenos utilizados como vacunas y su mecanismo de acción
Atenuadas
BCG: debido a su capacidad de estimular la respuesta inmunitaria mediada por linfocitos T y, en menor medida, linfocitos B. Su eficacia es menor para tuberculosis pulmonar. Tras su administración intradérmica, la infección local se logra en el 99% de los casos. Esto activa a las células presentadoras de antígenos, células dendríticas y neutrófilos, que engullen, procesan y presentan a los antígenos de superficie del BCG (lipoarabinomanano) a los linfocitos T vírgenes, CD4+ y CD8+
Después de dos a tres meses aparece la inmunidad celular (y la prueba cutánea a tuberculina se torna positiva) que está mediada principalmente por linfocitos T CD4+, los cuales secretan citocinas (IFNγ, FNTα) que activan a los macrófagos para que destruyan a las micobacterias intracelulares vía radicales libres. Los linfocitos T citotóxicos CD8+ contribuyen mediante la producción de perforinas, granulisinas y granzimas que destruyen a los macrófagos infectados
Inactivadas
Vacuna Salk: Los anticuerpos de mucosa (sIgA) inducidos por las vacunas pueden neutralizar el poliovirus en el intestino resultando una reducción del tiempo de excreción del poliovirus tipo 1 y 3 en la faringe, en el intestino y las heces.
Toxoides
Toxoide tetánico: consiste en el bloqueo de la neurotransmisión inhibitoria, dando lugar a la
rigidez muscular y los espasmos característicos del tétanos generalizado
RNAm
Existen dos tipos de vacunas de ARN, las convencionales y las autorreplicables. En las convencionales, la vacuna contiene ARN mensajero (ARNm) que se traduce en proteínas que codifican el antígeno, empleando los ribosomas celulares. En las autorreplicables, la vacuna contiene un complejo de ARN-polimerasa dependiente de ARN que amplifica el ARNm, creando más copias del mismo para posteriormente traducirlo, con lo que se produce mayor cantidad del antígeno
ADENOVIRUS
En lugar de emplear microorganismos enteros, atenuados o inactivados, se sugirió la posibilidad de usar antígenos específicos del microorganismo.
Importancia del Esquema Nacional de Vacunación infantil de México
Las vacunas nos salvan la vida al protegernos de enfermedades que pueden llegar a ser mortales y mejoran nuestra calidad de vida. Son un producto que se obtiene a partir de microorganismos o gérmenes, y lo que hacen es entrenar a tu organismo para defenderse de agentes infecciosos.
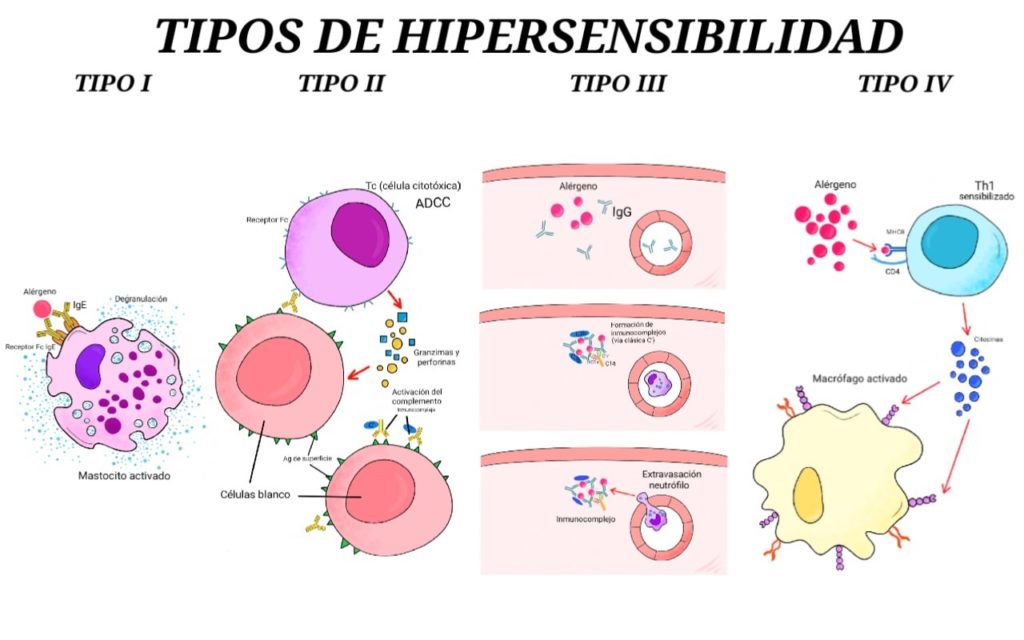
Tipo 1: Hipersensibilidad inmediata
Mediador: IgE, Mastocitos, Eosinofilos y Th2
Mecanismo efector: Activación de mastocitos
Patologías: Rinitis alérgica, asma bronquial, alergias alimentarias/medicamentos y anafilaxia
Tipo 2: Citotóxica, Neutralizante y Estimulante
Mediador: IgG/IgM, Neutrófilos, macrófagos y el Complemento
Mecanismo efector: Fagocitosis.
Activación de neutrófilos y macrófagos por complejos inmunes.
Patologías: Citopenias, Vasculitis, Nefritis y Sinovitis
Tipo III: Enfermedades por complejos inmunitarios
Mediador: IgG/IgM, Neutrófilos, Macrófagos, Complemento
Mecanismo efector: Activación de neutrófilos y macrófagos por complejos inmunes
Patologías: Enf. del suero, Vasculitis, Nefritis y Sinovitis
Tipo IV: Reacciones de hipersensibilidad tardía o mediada por célula
Mediador: T CD4+ TH1
Macrófagos y T CD8+
Mecanismo efector: Activación de macrófagos por IFN -γ y Activación de células T CD8+
Patologías: Dermatitis de contacto, Reacción a tuberculina, Granuloma y TBC.

Autoinmunidad
Tolerancia inmunitaria
Los mecanismos de tolerancia son esenciales para el control de la autorreactivad, principalmente, los mediados en periferia por los linfocitos T. Estos mecanismos se dividen habitualmente en tolerancia central, tolerancia periférica y tolerancia mediada por células T reguladoras (Treg).
Deleción clonal
Este mecanismo implica la muerte de los linfocitos autorreactivos al hacer contacto con el antígeno propio con una alta especificidad.
Anergia clona
Es necesario recordar que la activación del linfocito T requiere de varias señales: la primera, en la que el antígeno es presentado al receptor de la célula T por la célula presentadora de antígeno, en el contexto de la molécula del complejo mayor de histocompatibilidad
Ignorancia clonal
Dos posibles explicaciones a este fenómeno
la primera es que el autoantígeno está en muy bajas concentraciones, insuficientes para emitir una adecuada primera señal
la segunda tiene que ver con la existencia de sitios inmunológicamente privilegiados como el sistema nervioso central
Autoinmunidad y Enfermedades autoinmunitarias
La autoinmunidad es una respuesta inmune contra uno o varios antígenos propios. Para que se produzca la autoinmunidad es necesario que exista reconocimiento previo del sistema inmune a estos antígenos propios. Este proceso se denomina autorreactividad y es esencial tanto en la defensa contra patógenos que mimetizan nuestros antígenos como contra el cáncer
Factores que participan en la inducción de la autoinmunidad
Genético
Los genes que codifican para las moléculas del HLA se ubican en el brazo corto del cromosoma 6 en la región del (MHC).
En esta región se incluyen aquellos que codifican para las proteínas del complemento, componentes involucrados en el procesamiento intracelular de péptidos (TAP1, TAP2)
Las moléculas HLA-I presentan fundamentalmente péptidos citosólicos (como los virales o tumorales) a las células T citotóxicas CD8+ mientras que las moléculas HLA de clase II presentan, generalmente, péptidos extracelulares (como los bacterianos) a los linfocitos T cooperadores CD4+.
Ambientales
El mecanismo de acción propuesto para estos factores se basa en la liberación de sustancias proinflamatorias que inducen la expresión de señales de peligro y la consecuente activación de clones de linfocitos T autorreactivos.
Hormonas
La inducción de la tolerancia central tiene lugar en el timo para las células T
inmaduras y en la medula ósea para las células B. Durante la ontogenia de los
linfocitos, aquellos receptores de linfocitos T (TCR) que reconocen con levada afinidad/avidez péptidos propios expuestos en las moléculas del HLA son eliminados por deleción clonal, con el objetivo de evitar los clones autorreactivos.
Clasificación de las enfermedades autoinmunitarias
órgano específico
Tiroiditis de Hashimoto
Es una enfermedad en la que las células del sistema inmune, como los linfocitos T citotóxicos, atacan, por error, a la glándula tiroides, dañándola y provocando inflamación.
sistémicas
Lupus eritematoso sistémico
Lupus es más frecuentes (hasta 10 veces) en los familiares de los pacientes con LES, que en la población general. Se ha demostrado asociación de LES con antígenos HLA clase 2
Genes del complejo mayor de histocompatibilidad (CMH) particularmente HLA-A1, B8 y DR3 se han ligado a lupus, la respuesta de los linfocitos T al antígeno es desencadenada cuando el receptor de la molécula en la superficie de la célula T reconoce el complejo formado por el antígeno y el péptido del CMH en la superficie de la célula presentadora de antígeno (CPA).
Diferentes tipos de células del sistema inmune actúan como presentadoras de antígeno tales como los linfocitos B, células dendríticas (CD) y macrófagos. El genotipo del CMH determina cuáles moléculas estarán disponibles para los antígenos presentados y consecuentemente serán reconocidas por las células T
Artritis reumatoide
Una vez que se desencadena la enfermedad, las células del sistema inmunitario migran hacia el interior de las articulaciones, donde producen grandes cantidades de mediadores inmunitarios (citocinas / quimiocinas), que favorecen la activación y reclutamiento de más células del sistema inmunitario a los tejidos.
las células presentadoras de antígeno interaccionan con las células T para inducir la producción de mediadores inmunitarios que activan más células, por ejemplo, células T y B. Éstas últimas producen anticuerpos autorreactivos frente a la inmunoglobulina G (IgG) que pueden usarse como marcador diagnóstico y pronóstico.

Inmunodeficiencias
Primarias
Dichas enfermedades suelen estar presentes desde el nacimiento y son trastornos genéticos que suelen ser hereditarios. De modo característico se manifiestan durante el primer año de vida o en la infancia.
se clasifican según la parte del sistema inmunitario afectada
Inmunidad humoral, relacionada con los linfocitos B (células B), un tipo de glóbulos blancos (leucocitos) que producen anticuerpos (inmunoglobulinas), Inmunidad celular, relacionada con los linfocitos T (células T), un tipo de glóbulos blancos (leucocitos) que ayudan a detectar y destruir las células extrañas o anómalas, Inmunidad tanto humoral como celular (células B y células T), Fagocitos, células que ingieren (fagocitan) y destruyen a los microorganismos y Proteínas de complemento (proteínas que ayudan a las células inmunitarias a matar bacterias e identificar células extrañas para destruir)
Secundarias
suelen aparecer a una edad más avanzada y, por lo general, son consecuencia de la administración de ciertos medicamentos o de otro trastorno, como la diabetes o el virus de la inmunodeficiencia humana (VIH). Son más frecuentes que las primarias.
Estos trastornos pueden ser el resultado de:
Padecer determinadas enfermedades prolongadas (crónicas) y/o graves, como diabetes o cáncer.
Fármacos o sustancias
Raramente, radioterapia
Desnutrición
Actualmente está ampliamente aceptado que la
malnutrición está asociada a alteraciones en el sistema inmunitario tanto de sus órganos centrales como de la respuesta inmune, especialmente de la inmunidad celular, pero también de la fagocitosis
Alteraciones morfológicas de los órganos
inmunocompetentes
La glándula tímica es el órgano linfoide central
del sistema inmunitario, donde los timocitos sufren
los procesos de maduración, tras los cuales se produce su migración a los órganos linfoides periféricos
Este proceso de diferenciación comprende una
expresión secuencial de diversos marcadores de
membrana y reordenaciones de los genes receptores
de células T (TCR).
Alteraciones genotípicas y funcionales
de los timocitos
La principal característica fenotípica de los timocitos que
La estrecha relación entre la nutrición y el sistema inmunitario
acompaña a una deficiencia en proteínas, minerales y vitaminas es la pérdida de células inmaduras CD4+CD8+.
Diabetes mellitus tipo 2
Se ha establecido que tanto la DM2 como la obesidad cursan con un estado inflamatorio crónico de bajo grado, como consecuencia del incremento en la masa del tejido adiposo y la producción de citocinas proinflamatorias.
En este proceso participan distintas células del sistema inmune. Las más estudiadas han sido los macrófagos y monocitos
se ha reportado la participación de otras células, tales como neutrófilos, mastocitos, eosinófilos, células dendríticas, natural killer (NK), natural killer de estirpe T (NKT) e inclusive células del sistema inmune adaptativo como los linfocitos Th1, Th2, T reguladoras (Tregs), Th17 y células B
