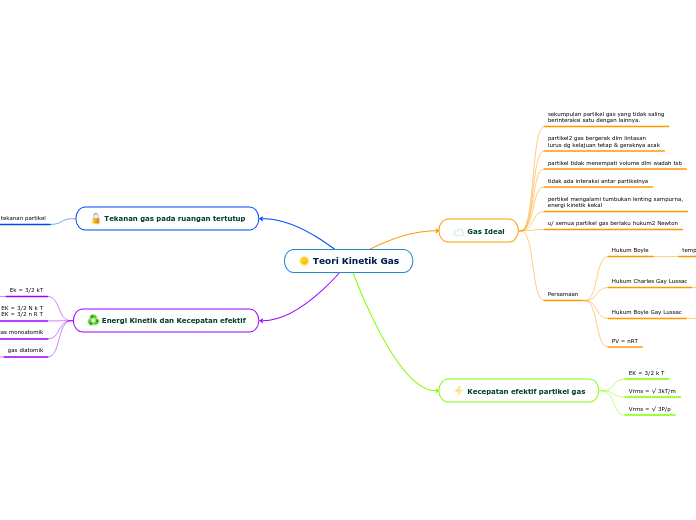
Teori Kinetik Gas
Gas Ideal
sekumpulan partikel gas yang tidak saling
berinteraksi satu dengan lainnya.
partikel2 gas bergerak dlm lintasan
lurus dg kelajuan tetap & geraknya acak
partikel tidak menempati volume dlm wadah tsb
tidak ada interaksi antar partikelnya
pertikel mengalami tumbukan lenting sampurna,
energi kinetik kekal
u/ semua partikel gas berlaku hukum2 Newton
Persamaan
Hukum Boyle
temperatur konstan
Hukum Charles Gay Lussac
tekanan konstan
Hukum Boyle Gay Lussac
P V / T = konstan
PV = nRT
Kecepatan efektif partikel gas
EK = 3/2 k T
Vrms = √ 3kT/m
Vrms = √ 3P/ρ
Tekanan gas pada ruangan tertutup
tekanan partikel
P = 1/3 . Nm₀V²/V
P = tekanan gas
m₀ = massa partikel gas
v² = rata-rata kuadrat kecepatan
N = jumlah partikel gas
V = volume gas
teorema ekipartisi energi
E = f (1/2 k T)
Energi Kinetik dan Kecepatan efektif
Ek = 3/2 kT
Example
EK = 3/2 N k T
EK = 3/2 n R T
gas monoatomik
f = 3
EK = 3/2 k T
gas diatomik
f = 5
EK = 5/2 k T