realizată de Emilia Garcia 5 ani în urmă
503
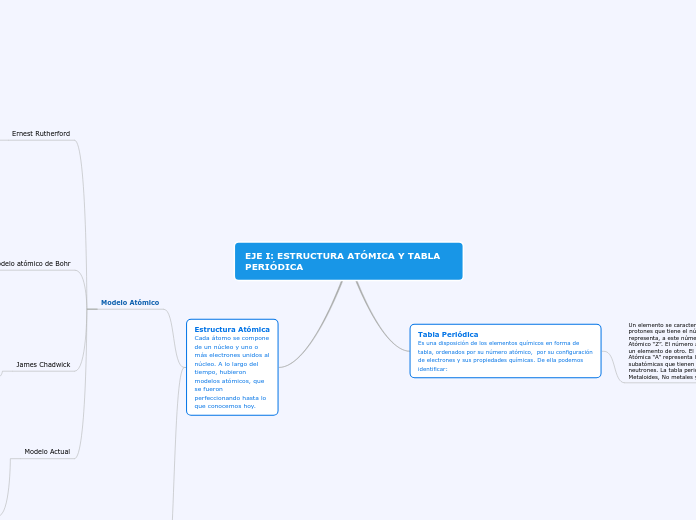
EJE I: ESTRUCTURA ATÓMICA Y TABLA PERIÓDICA
realizată de Emilia Garcia 5 ani în urmă
503

Mai multe ca acesta
1-Los electrones entran primero en el subnivel de menor energía. El orden de las energías relativas de los distintos subniveles es: 1s; 2s; 2p, 3s, 3p; 4s; 3d; 4p; 5s……… Al llegar al orbital “3p” se produce la primera inversión en el orden debido al “traslape” de los subniveles. 2-El principio de exclusión de Pauli, restringe la cantidad de electrones por cada subnivel y establece que: “dos electrones cualesquiera de un mismo átomo no pueden tener cuatro números cuánticos iguales”. en un mismo orbital se pueden ubicar dos electrones solo si tienen distinto spin. Este principio prohíbe la presencia de más de dos electrones por subnivel y nos permite calcular teóricamente el número máximo de electrones en cada nivel energético, según la fórmula 2n2. 3-La regla de multiplicidad máxima o regla de Hund se aplica cuando es necesario decidir la manera de llenar 2 orbitales del mismo nivel energético. Es decir que antes de completar un orbital, cada uno de los orbitales del mismo subnivel debe contener por lo menos un electrón.
Cuando un electrón pasa de una órbita externa a otra más cercana al núcleo, emite energía en forma de luz. Esta energía emitida es lo que llamamos espectro de emisión del átomo. Como cada tipo de átomo tiene su propia separación entre niveles, la luz que emite será diferente de la emiten otros tipos de átomos.Por lo tanto, para determinar la presencia de algunos elementos metálicos se puede utilizar el llamado ENSAYO A LA LLAMA, ya que los compuestos de algunos metales son volátiles en la llama de un mechero de Bunsen y le imparten un color característico. El análisis a la llama es uno de los primeros ensayos que se hacen sobre una sustancia. Los únicos elementos que no dan color a la llama son el Berilio y el magnesio. Para la fabricación de pirotecnia, se utilizan productos como el potasio, el nitrato de estroncio, entre otros.
Sobre la base de las investigaciones de Rutherford y Bohr, del descubrimiento de Chadwick y del Principio de incertidumbre de Heisenberg en la actualidad la estructura del átomo se puede resumir del siguiente modo: El átomo está compuesto por protones, neutrones y electrones. Este consta de un núcleo formado por protones y neutrones. El núcleo tiene carga positiva porque los protones son positivos y los neutrones carecen de carga. En la zona extra nuclear se encuentran los electrones cuya masa es despreciable. Los electrones se ubican a diferentes distancias del núcleo en determinados niveles de energía. Cada uno de ellos solo admiten un cierto número de electrones. Ellos no giran en órbitas circulares definidas, sino que se mueven en zonas o nubes que rodean al núcleo llamadas orbitales. La cantidad de protones positivos es igual a la cantidad de electrones negativos, de modo que el átomo en su conjunto es eléctricamente neutro.
Descubrió la existencia del neutrón en 1932, cuando comprobó que los núcleos de berilio podían emitir partículas sin carga eléctrica, cuya masa era aproximadamente igual a la del protón.
Los electrones no poseen cualquier cantidad de energía sino valores determinados. Ellos solo pueden girar alrededor del núcleo positivo en determinadas órbitas circulares, denominadas niveles o estados de energía. Mientras los electrones se encuentran en dichos niveles no emiten energía, por lo cual se denominan niveles o estados estacionarios. Cuando el electrón gira en la órbita más próxima al núcleo se encuentra en su estado más estable. Cuando un electrón “salta” a una órbita superior, absorbe energía que recibe del exterior. Cuando “salta” a una órbita inferior, pierde un cuanto de energía generalmente en forma de luz. Los electrones solo pueden variar de energía pasando de un nivel a otro en forma brusca e instantánea y no por una transición gradual. Los niveles de energía se identifican con números naturales, denominados números cuánticos principales. Nivel de energía es sinónimo de órbita o capa. Dichos niveles también se identifican con las letras K, L, M, N, O, P y Q. Cada nivel tiene una cantidad determinada de electrones. La diferencia de energía entre los niveles va siendo cada vez menor a medida que se aleja del núcleo.
El átomo está formado por un núcleo central, con carga eléctrica positiva, rodeado por los electrones negativos. El núcleo es muy pequeño con relación al diámetro total del átomo, pero contiene la mayor parte de la masa atómica. Los electrones giran alrededor del núcleo sin chocar con él, a distancias variables pero sin exceder un cierto diámetro. El número de electrones es el suficiente para compensar la carga positiva del núcleo, de manera que el átomo, en conjunto, resulta neutro. Los electrones tienen una masa despreciable con relación a la masa total del átomo.
Cuando un átomo pierde electrones se carga positivamente, se llama catión.
Cuando un átomo gana electrones se carga negativamente, se los llama aniones
Átomos de distintos elementos que tienen igual número másico pero distinto número atómico. Sus propiedades son por lo tanto distintas.
Átomos de un mismo elemento que presenta un número distinto de neutrones,