Materia: Química Tecnica
Foro: “Clasificación de los elementos en Tabla Periódica”
Mapa Conceptual elaborado por: Jorge Esli Castro Renderos
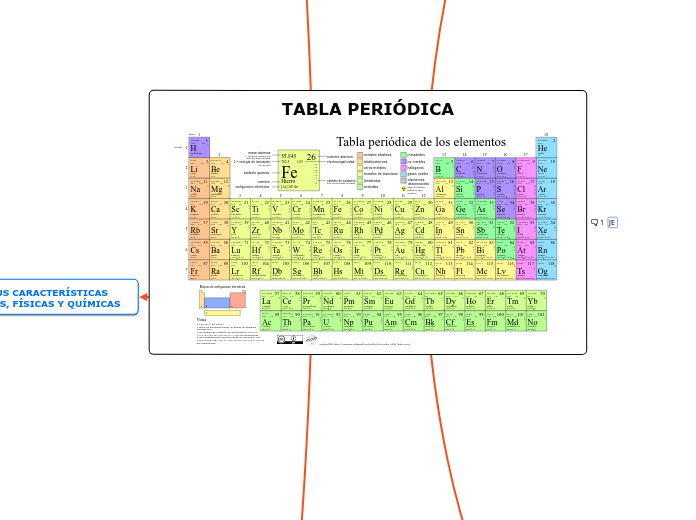
TABLA PERIÓDICA
Type in the name of your project.
La tabla periódica es una representación gráfica de todos los elementos químicos conocidos, organizados en función de sus propiedades y características comunes. La tabla periódica es una herramienta esencial en la química y la ciencia en general, ya que proporciona información valiosa sobre los elementos, su configuración electrónica, su reactividad química, sus propiedades físicas, entre otras cosas.
La tabla periódica está organizada en filas horizontales llamadas periodos y columnas verticales llamadas grupos o familias. Los elementos de un mismo grupo tienen propiedades químicas y físicas similares, mientras que los elementos de un mismo período tienen características en común relacionadas con la distribución electrónica.
La tabla periódica se basa en la ley periódica, que establece que las propiedades químicas y físicas de los elementos son funciones periódicas de su número atómico. El número atómico es el número de protones en el núcleo de un átomo, y determina la identidad química de un elemento.
SEGÚN
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS
ELECTRONEGATIVIDAD
La electronegatividad es una medida de la capacidad de un átomo para atraer electrones hacia sí mismo en una molécula covalente. En otras palabras, la electronegatividad es la capacidad de un átomo para atraer electrones hacia su núcleo. La electronegatividad se mide en una escala adimensional, siendo la escala de Pauling la más comúnmente utilizada.
La electronegatividad es una propiedad periódica que tiende a aumentar de izquierda a derecha en la tabla periódica, mientras que disminuye de arriba hacia abajo. Esto se debe a que, a medida que se mueve hacia la derecha de un período, los átomos tienen una carga nuclear efectiva más alta, lo que significa que los electrones en la capa externa están más fuertemente atraídos hacia el núcleo y, por lo tanto, son más electronegativos. Del mismo modo, a medida que se mueve hacia abajo de un grupo, el tamaño del átomo aumenta, lo que significa que los electrones en la capa externa están más lejos del núcleo y, por lo tanto, son menos electronegativos.
La electronegatividad es una propiedad importante en la química, ya que puede determinar la polaridad de una molécula y la distribución de carga en una molécula. Los átomos altamente electronegativos tienden a atraer electrones hacia sí mismos y, por lo tanto, pueden formar enlaces covalentes polares con átomos menos electronegativos.
ES UNA MEDIDA DE LA HABILIDAD DE UN ATOMO PARA ATRAER ELECTRONES HACIA SI MISMO CUANDO FORMA UN ENLACE QUIMICO CON OTRO ÁTOMO
ELECTRONEGATIVIDAD BAJA
TIENEN MENOS CAPACIDAD PARA ATRAER ELECTRONES
ELECTRONEGATIVIDAD ALTA
TIENEN UNA GRAN CAPACIDAD PARA ATRAER ELECTRONES
AFINIDAD ELECTRÓNICA
La afinidad electrónica es la cantidad de energía liberada cuando un átomo neutro en su estado fundamental gana un electrón para convertirse en un ion negativo (anión). La afinidad electrónica se mide en unidades de energía por mol (kJ/mol) o en electronvoltios (eV).
La afinidad electrónica es una propiedad periódica que tiende a aumentar de izquierda a derecha en la tabla periódica, mientras que disminuye de arriba hacia abajo. Esto se debe a que, a medida que se mueve hacia la derecha de un período, los átomos tienen una carga nuclear efectiva más alta, lo que significa que los electrones en la capa externa están más fuertemente atraídos hacia el núcleo y, por lo tanto, son menos propensos a ganar un electrón adicional. Del mismo modo, a medida que se mueve hacia abajo de un grupo, el tamaño del átomo aumenta, lo que significa que los electrones en la capa externa están más lejos del núcleo y, por lo tanto, son menos atraídos a ganar un electrón adicional.
Sin embargo, como con otras propiedades periódicas, puede haber excepciones a esta tendencia general debido a factores como la estabilidad de la configuración electrónica de un átomo y la influencia de la carga nuclear efectiva.
ES LA ENERGIA INTERCAMBIADA EN EL PROCESO POR EL QUE UN ATOMO NEUTRO EN ESTADO GASEOSO, RECIBE UN ELECTRÓN Y SE CONVIERTE EN UN ANIÓN
DENTRO DE UN PERIODO AUMENTA CONFORME DISMINUYE EL NUMERO ATOMICO
DENTRO DE UN GRUPO, AUMENTA AL AUMENTAR EL NUMERO ATÓMICO
ENERGÍA DE IONIZACIÓN
La energía de ionización es la cantidad de energía necesaria para eliminar un electrón de un átomo gaseoso neutro en su estado fundamental. La energía de ionización se mide en unidades de energía por mol (kJ/mol) o en electronvoltios (eV).
La energía de ionización es una propiedad periódica que tiende a aumentar de izquierda a derecha y de abajo hacia arriba en la tabla periódica. Esto se debe a que, a medida que se mueve hacia la derecha de un período, los átomos tienen una carga nuclear efectiva más alta, lo que significa que los electrones en la capa externa están más fuertemente atraídos hacia el núcleo y, por lo tanto, requieren más energía para ser removidos. Del mismo modo, a medida que se mueve hacia arriba de un grupo, el tamaño del átomo disminuye y la carga nuclear efectiva aumenta, lo que también hace que sea más difícil eliminar un electrón.
La energía de ionización puede variar dependiendo del átomo específico y del electrón que se esté eliminando. Por ejemplo, la eliminación de un electrón de una capa interna de un átomo requiere más energía que la eliminación de un electrón de la capa externa. Además, algunos elementos tienen excepciones a la tendencia general de la energía de ionización en la tabla periódica debido a factores como la estabilidad de la configuración electrónica de un átomo y la influencia de la carga nuclear efectiva.
ES LA ENERGÍA INVOLUCRADA EN EL PROCESO POR EL QUE UN ATOMO NEUTRO EN ESTADO GASEOSO, CEDE UN ELECTRON DE SU NIVEL EXTERNO Y SE CONVIERTE EN UN CATIÓN
DENTRO DE UN PERIODO AUMENTA CONFORME CRECE EL NUMERO ATOMICO
DENTRO DE UN GRUPO, AUMENTA AL DISMINUIR EL NUMERO ATOMICO
RADIO IÓNICO (RI)
El radio iónico se refiere al tamaño de un ion, que es un átomo que ha ganado o perdido electrones y, por lo tanto, tiene una carga eléctrica positiva o negativa. El radio iónico también es una propiedad periódica que varía de manera predecible a lo largo de la tabla periódica.
En general, el radio iónico de un ion positivo (catión) es menor que el radio atómico del átomo neutro a partir del cual se formó el catión. Esto se debe a que cuando un átomo pierde electrones para formar un catión, la atracción entre el núcleo y los electrones restantes se incrementa, lo que reduce el tamaño del ion.
Por otro lado, el radio iónico de un ion negativo (anión) es mayor que el radio atómico del átomo neutro a partir del cual se formó el anión. Esto se debe a que cuando un átomo gana electrones para formar un anión, la repulsión entre los electrones adicionales y los electrones existentes en la capa externa de valencia del átomo hace que la capa se expanda, lo que aumenta el tamaño del ion.
Al igual que con el radio atómico, el radio iónico también está influenciado por otros factores, como la carga nuclear efectiva y la estructura electrónica, por lo que pueden existir algunas excepciones a la tendencia general de variación del tamaño de los iones a lo largo de la tabla periódica.
RADIO IÓNICO
ES CUANDO UN ATOMO SE IONIZA
MODIFICA SU VOLUMEN
SI
GANA ELECTRONES
SE CONVIERTE EN CATIÓN
EL RADIO DEL ANIÓN MAYOR QUE EL NEUTRO
PIERDE ELECTRONES
SE CONVIERTE EN ANIÓN
POR LO TANTO
EL RADIO DE UN CATIÓN MENOR QUE EL
DEL ÁTOMO NEUTRO CORRESPONDIENTE
RADIO ATÓMICO
El radio atómico se refiere al tamaño del átomo, es decir, la distancia entre el núcleo del átomo y su capa externa de electrones. El radio atómico es una propiedad periódica, lo que significa que tiende a variar de manera predecible a lo largo de la tabla periódica.
En general, el radio atómico aumenta de derecha a izquierda y de arriba a abajo en la tabla periódica. Esto se debe a que a medida que se mueve hacia la izquierda de un período, los átomos tienen menos protones en el núcleo, lo que significa que la atracción entre el núcleo y los electrones es menor, y los electrones pueden extenderse más lejos. Del mismo modo, a medida que se mueve hacia abajo de un grupo, el número de capas electrónicas aumenta, lo que también aumenta el tamaño del átomo.
Es importante tener en cuenta que hay algunas excepciones a esta tendencia general, especialmente cuando se comparan átomos que se encuentran en diferentes grupos y períodos en la tabla periódica. En esos casos, otros factores, como la carga nuclear efectiva y la estructura electrónica, pueden influir en el tamaño del átomo.
ASIGNA A CADA ELEMENTO UN RADIO ATOMICO APROXIMADO LA MITAD DE LA DISTANCIA ENTRE LOS NUCLEOS DE LOS ATOMOS.
VARIA
DENTRO DE UN PERIODO, EL RADIO ATÓMICO AUMENTA CONFORME DISMINUYE EL NUMERO ATOMICO
DENTRO DE UN GRUPO, AUMENTA
CONFORME CRECE EL NUMERO ATOMICO
SEGÚN SUS CARACTERÍSTICAS
PERÍODICAS, FÍSICAS Y QUÍMICAS
SEGÚN SUS CARACTERÍSTICAS QUÍMICAS
Los elementos representativos, metales de transición, elementos de transición interna y gases nobles tienen diferentes propiedades químicas y físicas que les dan diferentes aplicaciones y usos. A continuación se detallan algunas de las aplicaciones de cada uno de estos grupos de elementos:
Elementos representativos:
- Los metales representativos, como el sodio y el potasio, se utilizan en la producción de aleaciones y en la fabricación de baterías y dispositivos electrónicos.
- Los no metales representativos, como el oxígeno y el cloro, se utilizan en la producción de compuestos químicos, en la purificación de agua y en la producción de alimentos y medicamentos.
Metales de transición:
- Los metales de transición, como el hierro y el cobre, se utilizan en la producción de materiales de construcción, como el acero y el cobre, y en la fabricación de maquinaria y herramientas.
- Los metales de transición también se utilizan en la producción de aleaciones, como el acero inoxidable, y en la producción de imanes y productos electrónicos.
Elementos de transición interna:
- Los elementos de transición interna, como el uranio y el plutonio, se utilizan en la producción de energía nuclear y en la fabricación de armas nucleares.
- Los elementos de transición interna también se utilizan en la producción de aleaciones especiales y en la fabricación de dispositivos electrónicos avanzados, como las pantallas de televisores y los paneles solares.
Gases nobles:
- Los gases nobles, como el helio y el argón, se utilizan en la iluminación y en la fabricación de dispositivos electrónicos, como los tubos de rayos catódicos.
- El gas noble xenón se utiliza en la medicina, en la producción de lámparas especiales y en la fabricación de equipos de iluminación avanzados.
En resumen, los diferentes grupos de elementos de la tabla periódica tienen aplicaciones importantes y variadas en la tecnología, la industria y la vida cotidiana.
Gases Nobles
Gases nobles: son los elementos que se encuentran en el grupo 18 de la tabla periódica. Estos elementos tienen configuraciones electrónicas muy estables y, por lo tanto, tienden a ser muy poco reactivos químicamente. Son gases inodoros, incoloros y no inflamables a temperatura y presión estándar, y se utilizan en diversas aplicaciones, como en la iluminación y la refrigeración.
Elementos de Transición interna
Elementos de transición interna: son los elementos que se encuentran en los dos períodos inferiores de la tabla periódica, debajo de los elementos de transición. Se llaman "de transición interna" porque sus electrones de valencia se encuentran en subniveles f de energía. Estos elementos también tienen propiedades químicas y físicas distintivas, como la capacidad de formar compuestos magnéticos y tener alta densidad.
Metales de Transición
Metales de transición: son los elementos que se encuentran en los grupos 3 a 12 de la tabla periódica. Se llaman "metales de transición" porque sus electrones de valencia se encuentran en subniveles d de energía, lo que les da propiedades químicas y físicas distintivas, como la capacidad de formar compuestos coloridos y tener alta conductividad eléctrica y térmica.
Elementos Representativos
Elementos representativos: son los elementos que se encuentran en los grupos 1, 2 y 13 a 18 de la tabla periódica. Se les llama "representativos" porque tienen configuraciones electrónicas que se repiten de manera predecible y que "representan" a otros elementos en su grupo. Estos elementos tienden a tener propiedades químicas similares y se pueden dividir en dos grupos principales: los metales representativos y los no metales representativos.
SEGÚN CARACTERÍSTICAS FÍSICAS
La clasificación de los elementos de la tabla periódica según sus características físicas nos permite distinguir los elementos según sus propiedades macroscópicas, como su conductividad eléctrica, su brillo o su fragilidad, lo que es útil en la identificación y el estudio de los diferentes elementos y compuestos químicos.
No Metales
No metales: Los no metales son elementos que tienen una baja conductividad térmica y eléctrica, no son brillantes ni reflectantes, y tienen una baja densidad y punto de fusión. La mayoría de los no metales son gases a temperatura ambiente, como el oxígeno y el nitrógeno, aunque algunos son sólidos, como el azufre, y algunos son líquidos, como el bromo. Los no metales se caracterizan por ser frágiles y quebradizos, lo que significa que se rompen fácilmente cuando se someten a esfuerzos. Ejemplos de no metales son el carbono, el nitrógeno y el oxígeno.
GASES NOBLES
HALÓGENOS
OTROS NO METALES
Metaloides
Metaloides: Los metaloides son elementos que tienen propiedades intermedias entre los metales y los no metales. Estos elementos tienen una conductividad térmica y eléctrica que está entre la de los metales y los no metales, y tienen una densidad y punto de fusión que también están en el rango intermedio. Los metaloides se caracterizan por ser dúctiles y maleables como los metales, pero también son quebradizos como los no metales. Ejemplos de metaloides son el silicio, el germanio y el arsénico.
Metales
Metales: Los metales son elementos que tienen una alta conductividad térmica y eléctrica, son brillantes y reflectantes y tienen una elevada densidad y punto de fusión. La mayoría de los metales son sólidos a temperatura ambiente, excepto el mercurio, que es líquido. Los metales se caracterizan por ser dúctiles y maleables, lo que significa que pueden ser estirados y moldeados en formas diferentes sin romperse. Ejemplos de metales son el hierro, el oro, el cobre y el aluminio.
OTROS METALES
LANTÁNIDOS / ACTÍNIDOS
METALES DE
TRANSICIÓN / BLOQUE D
ALCALINOTÉRREOS
ALCALINOS
SEGÚN CARACTERÍSTICAS PERIÓDICAS
La clasificación de los elementos de la tabla periódica según sus características periódicas se divide en cuatro bloques principales: elementos del bloque s, elementos del bloque p, elementos del bloque d y elementos del bloque f.
La clasificación de los elementos de la tabla periódica según sus características periódicas nos permite distinguir los elementos según su estructura electrónica y su posición en la tabla periódica, lo que es útil en la identificación y el estudio de los diferentes elementos y compuestos químicos.
BLOQUE "F"
Elementos del bloque F: Los elementos del bloque f son aquellos que tienen su último electrón en la capa f de la estructura electrónica, y por lo tanto están ubicados en la parte inferior de la tabla periódica. Estos elementos tienen una configuración electrónica externa variable y son elementos de transición interna. Los elementos del bloque f son conocidos como los lantánidos y los actínidos y son altamente radiactivos. Ejemplos de elementos del bloque f son el uranio y el plutonio.
Comprende las tierras raras (lantánidos) y actínidos. No posee números de grupo propios, aunque se asume que estos elementos pertenecerían al 3.
BLOQUE "D"
Elementos del bloque D: Los elementos del bloque d son aquellos que tienen su último electrón en la capa d de la estructura electrónica, y por lo tanto están ubicados en la sección central de la tabla periódica. Estos elementos tienen una configuración electrónica externa variable y son metales de transición. Los elementos del bloque d tienen una alta densidad, un alto punto de fusión y un alto punto de ebullición. Ejemplos de elementos del bloque d son el hierro, el cobre y el oro.
Comprende los grupos del 3 al 12 y todos los metales de transición.
BLOQUE "P"
Elementos del bloque P: Los elementos del bloque p son aquellos que tienen su último electrón en la capa p de la estructura electrónica, y por lo tanto están ubicados en la tercera a la octava columna de la tabla periódica. Estos elementos tienen una configuración electrónica externa variable y pueden tener propiedades tanto metálicas como no metálicas. En general, los elementos del bloque p son no metales, como el carbono, el oxígeno y el nitrógeno, pero también pueden ser metaloides, como el silicio.
Comprende los últimos seis grupos, es decir, del 13 al 18 en la Tabla Periódica y además a todos los metaloides.
BLOQUE "S"
Elementos del bloque S: Los elementos del bloque s son aquellos que tienen su último electrón en la capa s de la estructura electrónica, y por lo tanto están ubicados en la primera y segunda columna de la tabla periódica. Estos elementos tienen una configuración electrónica externa estable y son altamente electropositivos. En general, los elementos del bloque s son metales alcalinos y alcalinotérreos, como el litio, el sodio y el calcio.
Comprende los dos primeros grupos, es decir, metales alcalinos y alcalinotérreos, además del hidrógeno y el helio.
INFORMACIÓN DE
CADA UNO DE SUS ELEMENTOS
Datos de cada elemento
Cada elemento de la tabla periódica contiene una serie de información que nos permite conocer sus propiedades físicas, químicas y electrónicas. A continuación, se describe la información que proporciona cada elemento de la tabla periódica:
- Símbolo químico: es la abreviatura que se utiliza para representar el elemento. Por ejemplo, el símbolo químico del hidrógeno es H, el del oxígeno es O y el del hierro es Fe.
- Número atómico: es el número de protones en el núcleo del átomo de un elemento. Este número es único para cada elemento y determina su posición en la tabla periódica.
- Nombre del elemento: es el nombre común que se utiliza para referirse al elemento. Por ejemplo, el nombre del elemento con el símbolo químico H es hidrógeno.
- Configuración electrónica: es la distribución de electrones en los diferentes orbitales atómicos de un átomo de un elemento. Esta información nos permite conocer la disposición de los electrones en el átomo y por lo tanto, predecir las propiedades químicas y electrónicas de los elementos.
- Peso atómico: es la masa promedio de los átomos de un elemento, teniendo en cuenta sus diferentes isótopos y sus abundancias relativas.
- Punto de fusión: es la temperatura a la cual un elemento pasa del estado sólido al estado líquido. Este valor nos indica la resistencia que tiene el elemento a cambiar de estado físico.
- Punto de ebullición: es la temperatura a la cual un elemento pasa del estado líquido al estado gaseoso. Este valor nos indica la facilidad con la que el elemento se vaporiza.
- Densidad: es la relación entre la masa de un elemento y su volumen. Este valor nos indica la concentración de masa en un determinado volumen de espacio.
- Estado natural: es la forma en que se encuentra el elemento en la naturaleza. Algunos elementos se encuentran en estado sólido, como el hierro, mientras que otros se encuentran en estado líquido, como el mercurio, o en estado gaseoso, como el oxígeno.
- Electronegatividad: es la capacidad de un átomo de un elemento para atraer electrones hacia sí mismo. Este valor nos indica la tendencia que tiene un elemento a formar enlaces químicos con otros elementos.
En resumen, la información contenida en cada elemento de la tabla periódica nos permite conocer sus propiedades físicas, químicas y electrónicas, lo que es fundamental para entender cómo se comportan los elementos en diferentes reacciones químicas y en diferentes condiciones físicas y ambientales.
NOMBRE
El nombre de un elemento puede estar relacionado
CON
SU USO
SU ORIGEN
SUS PROPIEDADES FÍSICAS O QUÍMICAS
SU DESCUBRIMIENTO
Cada elemento tiene un nombre único que lo identifica dentro de la tabla periódica de los elementos.
DENSIDAD
Se refiere a la cantidad de masa por unidad de volumen
La densidad se expresa
Unidades kg/m³ (kilogramos por metro cúbico)
Unidades de g/cm³ (gramos por centímetro cúbico)
SIMBOLO DE UN ELEMENTO
Se deriva generalmente del nombre del elemento
EN
GRIEGO
LATÍN
INGLÉS
Es una o dos letras que se utilizan para representarlo de manera abreviada en la tabla periódica
ESTRUCTURA ATÓMICA
Se compone de un núcleo central formado por protones y neutrones, rodeado por electrones en órbita alrededor del núcleo.
La estructura de un elemento depende de su posición en la tabla periódica y de las características de su núcleo y electrones
PUNTO DE FUSIÓN
El punto de fusión varía de un elemento a otro
La estructura cristalina del sólido
La masa atómica
La fuerza de los enlaces interatómicos
Es la temperatura a la cual su estado sólido se convierte en líquido en condiciones normales de presión (una atmósfera).
VALENCIA
Se determina por el número de electrones de valencia que tiene un átomo de ese elemento.
Es la capacidad de los átomos de ese elemento para combinarse con átomos de otros elementos y formar compuestos químicos.
PESO ATÓMICO
Se definen como la doceava parte de la masa de un átomo de carbono-12.
El peso atómico se expresa en unidades de masa atómica (u)
Es la masa promedio de los átomos de ese elemento en una muestra dada, en comparación con la masa de un átomo de carbono-12.
NÚMERO ATÓMICO
Es una propiedad fundamental de los elementos químicos y determina su lugar en la tabla periódica.
Cada elemento tiene un número atómico único y diferente.
Es el número de protones que tiene el núcleo de su átomo.
PUNTO DE EBULLICIÓN
El punto de ebullición varía de un elemento a otro
DEPENDE DE FACTORES COMO:
La geometría molecular
La masa molecular
La fuerza de los enlaces intermoleculares
Es la temperatura a la cual su estado líquido se convierte en gas en condiciones normales de presión (una atmósfera)
SEGÚN
GRUPOS, FAMILIAS Y PERIODOS
Who are the people who will work with you on the project?
PERIODOS
Who is the project manager?
Los períodos en la tabla periódica son las filas horizontales de elementos numeradas del 1 al 7, y se encuentran en la parte superior de la tabla periódica. Cada periodo representa un nivel principal diferente, que corresponde al número cuántico principal de los electrones de valencia de los elementos. A medida que avanzamos de izquierda a derecha en un periodo, el número atómico del elemento aumenta en una unidad y su configuración electrónica va cambiando. Cada periodo está compuesto por elementos con propiedades físicas y químicas similares.
Los elementos de un periodo tienen un número de capa de valencia creciente, lo que significa que la capa más externa de electrones se encuentra en un nivel principal cada vez mayor. Los elementos de los periodos más bajos tienen electrones en las capas más internas, mientras que los elementos de los periodos más altos tienen electrones en capas más externas.
A medida que se mueve de izquierda a derecha en un periodo, las propiedades de los elementos cambian gradualmente. Los elementos en la parte izquierda del periodo son metales altamente reactivos, mientras que los elementos en la parte derecha son no metales altamente electronegativos. Los elementos de transición se encuentran en el medio del periodo y tienen una variedad de propiedades químicas y físicas.
En resumen, los periodos son filas horizontales en la tabla periódica que representan niveles principales diferentes de los electrones de valencia de los elementos. Los elementos de un periodo tienen propiedades físicas y químicas similares y se organizan de izquierda a derecha en orden creciente de número atómico. A medida que se mueve de izquierda a derecha en un periodo, las propiedades de los elementos cambian gradualmente de metales altamente reactivos a no metales altamente electronegativos.
SEPTIMO PERIODO
SEXTO PERIODO
32 Elementos
QUINTO PERIODO
CUARTO PERIODO
18 Elementos
TERCER PERIODO
SEGUNDO PERIODO
8 Elementos
PRIMER PERIODO
2 Elementos
FAMILIAS
A continuación, se presenta una breve explicación de cada una de las familias de la tabla periódica:
- Familia del hidrógeno o de los metales alcalinos: esta familia está compuesta por elementos altamente reactivos, que son buenos conductores de electricidad y que tienen un solo electrón en su capa externa. El hidrógeno comparte algunas propiedades con estos elementos.
- Familia de los metales alcalinotérreos: esta familia está compuesta por elementos que también son altamente reactivos y tienen una configuración electrónica de dos electrones en su capa externa. Se les llama alcalinotérreos porque sus óxidos son básicos y reaccionan con agua para formar soluciones alcalinas.
- Del a 12. Familias del escandio, titanio, vanadio, cromo, manganeso, hierro, cobalto, níquel, cobre y zinc: Estas familias están formadas por los elementos de transición, que son metales que tienen una configuración electrónica incompleta en su capa externa. Son buenos conductores de calor y electricidad, tienen puntos de fusión y ebullición altos y son resistentes a la corrosión. Estos elementos se utilizan comúnmente en la industria, la construcción, la electrónica y la joyería.
- Familia del boro o de los metales del grupo del aluminio: esta familia incluye elementos que son semimetales y metales, que tienen tres electrones en su capa externa y son menos reactivos que los elementos de los grupos 1 y 2.
- Familia del carbono o de los elementos del grupo del carbono: esta familia incluye elementos no metales y semimetales, que tienen cuatro electrones en su capa externa y son muy importantes para la química orgánica, debido a su capacidad para formar enlaces covalentes estables y complejos.
- Familia del nitrógeno o de los pnictógenos: esta familia incluye elementos no metales que tienen cinco electrones en su capa externa y son importantes para la producción de fertilizantes, debido a su capacidad para formar compuestos nitrogenados.
- Familia del oxígeno o de los calcógenos: esta familia incluye elementos no metales que tienen seis electrones en su capa externa y son importantes para la vida, ya que el oxígeno es esencial para la respiración celular.
- Familia de los halógenos: esta familia incluye elementos no metales que tienen siete electrones en su capa externa y son altamente reactivos y electronegativos. Estos elementos se utilizan en la producción de haluros y en la purificación de agua.
- Familia de los gases nobles o inertes: esta familia incluye elementos no metales que tienen una configuración electrónica completa en su capa externa. Estos elementos son extremadamente estables y no reactivos, lo que los hace útiles en la iluminación, la refrigeración y la soldadura.
Otros Metales
Familia de los Gases Nobles:
Grupo 18 (VIIIa)
Familia de los Halógenos:
Grupo 17 (VIIA)
Familia del Oxígeno o Calcógenos:
Grupo 16 (VIA)
Familia del Nitrógeno o Nitrogenoides:
Grupo 15 (V A)
Familia del Carbono o Carbonoides:
Grupo 14 (IV A)
Familia del Boro o Térreos:
Grupo 13 (III A)
Familia de los Metales de transición:
Grupos del 3 al 12 ( I B al VIII B)
Familia de los Metales Alcalinotérreos:
Grupo 2 (II A)
Familia de Metales Alcalinos:
Grupo 1 (I A)
GRUPOS
What are the other team members?
Los grupos A y B son dos de las dos categorías principales de grupos en la tabla periódica. También se les llama grupos representativos (A) y grupos de transición (B).
Los grupos A son los primeros 18 grupos de la tabla periódica. Estos grupos se llaman "representativos" porque contienen elementos que representan a los elementos en la tabla periódica. Los elementos de los grupos A tienen configuraciones electrónicas similares en sus capas externas, lo que les da propiedades químicas similares. Los grupos A se dividen en cuatro subgrupos: grupo 1 (metales alcalinos), grupo 2 (metales alcalinotérreos), grupo 13 (boroideos) y grupo 14 a 18 (carbonoideos, nitrogenoideos, oxi- y halógenos, y gases nobles).
Los grupos B son los 10 grupos que se encuentran en el centro de la tabla periódica, después de los grupos A. Estos grupos se llaman "de transición" porque los elementos de estos grupos tienen configuraciones electrónicas de transición en sus capas externas. Los grupos B contienen los elementos de transición, que son los elementos de la tabla periódica que tienen electrones que se llenan en las capas internas. Los elementos de transición tienen propiedades químicas similares y se caracterizan por su alta densidad, punto de fusión y punto de ebullición. Los grupos B se dividen en dos subgrupos: grupo 3 a 12 (metales de transición) y grupo 13 a 18 (los p-blocks).
GRUPO B
Los elementos del grupo B de la tabla periódica se conocen como elementos de transición. Estos elementos tienen electrones en los orbitales d y f de sus capas externas. Los elementos de transición interna, que tienen electrones en los orbitales f, se encuentran en los dos bloques inferiores de la tabla periódica. El bloque d, que se encuentra en el medio de la tabla periódica, contiene los elementos de transición externa.
Los elementos de transición tienen algunas propiedades químicas y físicas únicas debido a sus electrones de valencia en los orbitales d y f. Por ejemplo, muchos elementos de transición tienen múltiples estados de oxidación, lo que significa que pueden formar iones con diferentes cargas eléctricas. Además, muchos elementos de transición tienen alta densidad, puntos de fusión y ebullición elevados, y son buenos conductores de calor y electricidad.
Los elementos de transición son útiles para muchas aplicaciones tecnológicas y de ingeniería. Por ejemplo, el hierro y el acero, que son aleaciones de hierro y otros elementos de transición, se utilizan en la construcción de edificios, puentes y maquinaria. Los metales de transición también se utilizan en la fabricación de electroimanes, catalizadores, baterías, cables eléctricos, pantallas de televisores y muchos otros productos.
Los elementos del grupo B también se subdividen en subgrupos. Los subgrupos 3-12 se conocen como los elementos de transición externa y a menudo se llaman metales de transición. Los subgrupos 13-16 a menudo se llaman elementos del bloque p y tienen una variedad de propiedades químicas y físicas. El subgrupo 17 contiene los halógenos altamente reactivos, mientras que el subgrupo 18 contiene los gases nobles inertes.
Grupo 12 (II B):
Familia del Zinc
Grupo 11 (I B):
Familia del Cobre
Grupo 10 (VIII B):
Familia del Níquel
Grupo 9 (VIII B):
Familia del Cobalto
Grupo 8 (VIII B):
Familia del hierro
Grupo 7 (VII B):
Familia del Manganeso
Grupo 6 (VI B):
Familia del Cromo
Grupo 5 (V B):
Familia del Vanadio
Grupo 4 (IV B):
Familia del Titanio
Grupo 3 (III B):
Familia del Escandio (tierras raras y actinidos)
GRUPO A
Type in the name of a team member.
El grupo A de la tabla periódica también se conoce como grupo de los elementos representativos, ya que los elementos de este grupo tienen una configuración electrónica en la que el último electrón agregado entra en un orbital s o p de la capa exterior.
Los elementos del grupo A se subdividen en varios subgrupos, que se identifican por el número de electrones de valencia que tienen en la capa externa. Los elementos del subgrupo 1, también conocido como grupo de los metales alcalinos, tienen un solo electrón de valencia en su capa exterior y son altamente reactivos, especialmente con agua. Los elementos del subgrupo 2, también conocido como grupo de los metales alcalinotérreos, tienen dos electrones de valencia y también son altamente reactivos, aunque menos que los metales alcalinos.
Los elementos del subgrupo 13 al 18 también se conocen como elementos del grupo de la familia del boro, familia del carbono, familia del nitrógeno, familia del oxígeno, familia del flúor y familia del helio, respectivamente. Todos estos elementos tienen una configuración electrónica similar en la capa exterior y comparten muchas de las mismas propiedades químicas y físicas. Por ejemplo, los elementos del grupo del carbono son conocidos por su capacidad para formar enlaces covalentes, mientras que los elementos del grupo del oxígeno son altamente electronegativos y forman compuestos oxidantes.
En general, los elementos del grupo A tienen una variedad de propiedades físicas y químicas, pero comparten muchas características comunes debido a su configuración electrónica similar en la capa exterior. Esto hace que sea más fácil predecir las propiedades químicas de los elementos del grupo A y comprender cómo interactúan entre sí y con otros elementos.
Grupo 18 (VIII A):
Gases nobles
Grupo 17 (VII A):
Halógenos
Grupo 16 (VI A):
Familia del Oxigeno
Grupo 15 (V A):
Familia del Nitrógeno
Grupo 14 (IV A):
Familia del Carbono
Grupo 13 (III A):
Familia del Boro
Grupo 2 (II A):
Los metales Alcalinotérreos
Grupo 1 (I A):
Los metales alcalinos
LINEA DEL TIEMPO
DE LA TABLA PERIODICA
Aquí te presento una línea del tiempo detallada de la evolución de la tabla periódica desde sus inicios hasta la actualidad:
- 1800: El químico británico John Dalton propone la primera lista de elementos conocidos. Dalton propone que los elementos son sustancias simples que no pueden ser descompuestas en sustancias más simples por medios químicos.
- 1829: Johann Dobereiner, químico alemán, propone la ley de las triadas, que agrupa a los elementos en grupos de tres en función de sus propiedades químicas.
- 1862: Alexandre-Emile Béguyer de Chancourtois, un geólogo francés, presenta una forma de organizar los elementos basándose en sus propiedades físicas y químicas en un cilindro. Esta forma de organización se llama "vis tellurique".
- 1869: El químico ruso Dmitri Mendeléyev presenta la primera tabla periódica, organizando los elementos según su peso atómico y sus propiedades químicas. Mendeléyev deja huecos en la tabla para los elementos que aún no se han descubierto.
- 1913: El químico inglés Henry Moseley descubre que el número atómico de un elemento es la propiedad fundamental que determina su posición en la tabla periódica. Moseley establece que el número atómico es el número de protones en el núcleo de un átomo.
- 1923: El químico húngaro Janos von Neumann propone una forma de representar la tabla periódica en una red tridimensional.
- 1940s: Se descubren los elementos transuránicos, que se agregan a la tabla periódica. Los elementos transuránicos son elementos con números atómicos superiores a 92, el número atómico del uranio.
- 1944: El físico británico Glenn Seaborg y su equipo descubren el plutonio. El descubrimiento del plutonio llevó a la reorganización de la tabla periódica, ya que el plutonio tenía propiedades diferentes a las del uranio, que se encuentra justo encima de él en la tabla.
- 1945: Seaborg propone la serie de actínidos, un grupo de elementos que comienzan con el actinio (número atómico 89) y terminan con el laurencio (número atómico 103).
- 1969: Glenn T. Seaborg propone una reorganización de la tabla periódica para reflejar mejor la estructura electrónica de los elementos. En la nueva tabla, los elementos se organizan en grupos según su configuración electrónica.
- 1985: El químico alemán E. Wiberg presenta una versión de la tabla periódica que muestra los elementos en grupos de acuerdo a su estructura electrónica. Esta versión de la tabla se llama tabla periódica ampliada.
- 2011: Los elementos 114 y 116 reciben oficialmente los nombres de flerovio y livermorio, respectivamente.
- 2016: Se agregan cuatro elementos más a la tabla periódica: nihonio, moscovio, tennesso y oganesón, completando el séptimo período de la tabla. Estos elementos se produjeron por medio de experimentos con aceleradores de part
Linea del tiempo de la Tabla Periodica