Espectrofotometría
La espectrofotometría es una técnica analítica utilizada para medir cuánta luz absorbe una sustancia química
Se caracteriza por su precisión, sensibilidad y su
aplicabilidad a moléculas de distinta naturaleza (contaminantes, biomoléculas, etc) y
estado de agregación (sólido, líquido, gas).
Las moléculas pueden absorber energía luminosa
Midiendo la intensidad de la luz cuando un haz luminoso pasa a través de la solución muestra, con base en la ley de Beer-Lambert
Espectroscopia
Se define como la ciencia que estudia las interacciones entre la radiación y la
materia
Los métodos espectroscópicos de análisis miden la cantidad de
radiación producida o absorbida por las especies atómicas o moleculares que
se analizan
Todos los espectrofotómetros contienen espectrómetros. Los espectrofotómetros de color, como nuestros dispositivos X-Rite, están diseñados y calibrados para detectar el espectro visible, o cerca de lo visible como ultravioleta (UV) o infrarrojo (IR).

Visible/Ultravioleta (UV)
Utiliza radiaciones electromagnéticas
Está basada en el proceso de absorción de la radiación ultravioleta-visible
fue propuesto por Ley Beer-Labert
Establece A=e.L.C
add new info
Como ejemplo: Cuando la luz visible brilla en una camisa azul, el tinte azul de la camisa refleja la luz azul y absorbe todos los demás colores que podemos ver.
Genera un espectro que representa absorbancia y reflejan bandas vibración-rotación, son bandas anchas
Produce transiciones electrónicas
cuya longitud de onda comprendida entre 100-8''nm
Alumno: Julián Alfonso Coronel Contreras
Grupo: BI-BQAN-2102-B2-004
Asignatura: Química Analítica
Bibliografía: Gravimetría y espectrofotometría. (s. f.). UNADm. Recuperado 25 de noviembre de 2021, de https://campus.unadmexico.mx/contenidos/DCSBA/BLOQUE2/BI/02/BQAN/unidad_04/descargables/BQAN_U4_Contenido.pdf
Infrarrojo (IR)
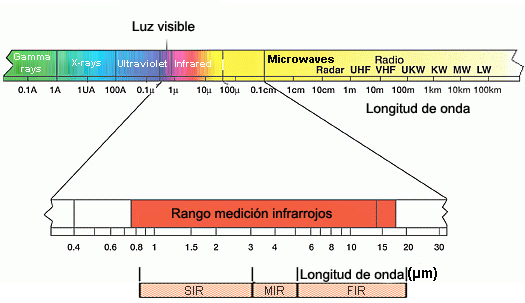
Los componentes con que se cuenta para la detección de infrarrojos
detector, computador
muestra, amplificador
fuente, detector
amplificador
Consiste en una técnica que se basa en la absorción de la radiación (IR) por las moléculas en vibración
La región del infrarrojo se localiza a frecuencias de 8x10-5 a 8x10-2 cm
Las muestras pueden ser solidas, liquidas o gaseosas
Los fotones de la
radiación infrarroja no tienen la energía suficiente para provocar transiciones electrónicas
Introducción a espectroscopía infrarroja
Espectrofotometría de absorción atómica
El método se fundamenta en que al hacer incidir
energía en forma de calor o de manera eléctrica en una muestra problema, mediante una llama o una descarga, provocará un cambio del estado basal al estado excitado del analito; de tal manera que los electrones más externos en un átomo, pasarán al estado excitado
son útiles los espectros de
emisión, contrarios a los de absorción
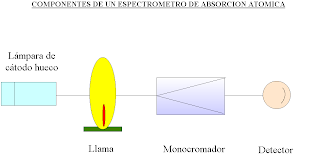
El equipo para la espectrofotometría de absorción atómica consta, de manera general: de una fuente de luz, el tomador de muestra, el atomizador, la fuente de excitación, el selector
de longitud de onda (monocromador) y el dispositivo de lectura
El método por excelencia para el análisis en espectroscopia de absorción atómica es el del estándar externo, el cual consiste en emplear al menos tres estándares para construir la
gráfica o curva de calibración
La técnica de la espectrofotometría de absorción atómica se ha aplicado a más de 60
elementos y es una herramienta indispensable para los estudios en los que se determinan vestigios de metales en muestras biológicas o del medio ambiente.

Clases de luz de diferente longitud de onda
Una banda de absorción es un intervalo de longitudes de onda o, equivalentemente, de frecuencias o de energías. Según la mecánica cuántica, los átomos y las moléculas pueden solamente absorber ciertas cantidades de energía o existir en estados específicos.
La banda de absorción se utiliza para identificar los componentes de algunas sustancias químicas, sobre todo líquidos y gases, y para determinar la estructura de compuestos orgánicos.
Casi todos los grupos funcionales orgánicos se localizan entre
los 4000 y 800 cm-1. Los espectros infrarrojos se presentan como gráficas de absorbanciafrente a número de onda
puede ser divida en tres zonas con el propósito de facilitar la identificación de un espectro
El espectro de emisión de un elemento químico o compuesto químico es el espectro de frecuencias de radiación electromagnética emitida debido a un átomo o molécula que realiza una transición de un estado de alta energía a un estado de menor energía.

7 tipos de onda
1 Radiofrecuencia.
2 Microondas.
3 Infrarrojo.
4 Espectro visible.
5 Ultravioleta.
6 Rayos X.
7 Rayos gamma