RELACIONES INTERATOMMICAS
Descubierto por:

Gilbert Newton Lewis

Estableció la teoría del enlace químico por compartición de pares de electrones
Son

Enlaces químicos formados por enlaces

Relaciones que mantienen a los átomos unidos entre si
Para mantener una estabilidad en su ultimo nivel de energía
Tipos de enlaces

Enlace Iónico
Relación dada por átomos metálicos y no metálicos
Debido a la transferencia permanente de electrones
Produce una molécula cargada electromagnéticamente como ion

Ejemplos: Oxido de Magnesio, Sulfato de Cobre, Ioduro de Potasio, Hidróxido de Zinc, etc.

Enlace Covalente
Relación dada entre elementos no metales y no metales
Se comparten 2, 4 o 6 electrones
Pueden tener enlaces simples, dobles o triples
Los enlaces son más fuertes entre átomos de igual electronegatividad
Subtopic
Tipos de enlace covalente

Polar
Enlace formado por átomos con diferencia de carga electronegativa de 0.4 a 1.7
Los electrones compartidos se mantienen más próximo a aquel átomo mas electronegativo.
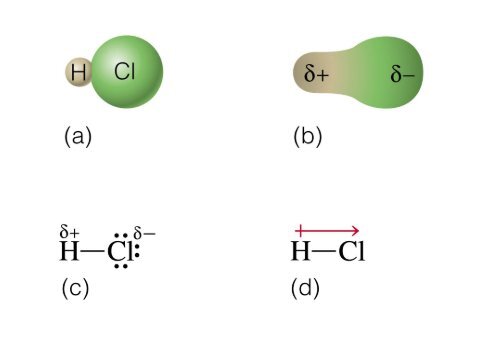
No polar
Unión establecida por átomos de igual electronegatividad
Este tipo de enlace se puede mantener entre átomos con una diferencia de carga electronegativa menor a 0.4
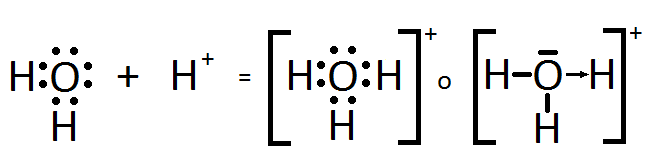
Coordinado
se presenta cuando uno de los átomos en la unión es el que aporta los electrones a compartir

Enlace Metálico

Relación dada entre elementos metales y metales
Los átomos de los metales necesitan ceder electrones para alcanzar la configuración de un gas noble.
Este tipo de enlace son sumamente compactas, sólidas y resistentes, dado que los núcleos de sus átomos se juntan a tal extremo, que comparten sus electrones de valencia.