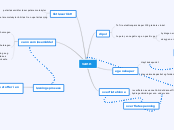
vann
dipol
To frie elektronpar skaper 105 graders vinkel
to poler, en negativ og en positiv pol
hydrogen er positivt ladd
hydrogen er den sterkeste av svake bindingen
oksygen er negativt ladd
egenskaper
Høyt kokepunkt
Høy varmekapasitet og fordampningsevne
fordampningsvarme: 2260 kj/kg
Varmekapasitet til vann er 4,2 kj (Kg K)
klima på jorden
overflatehinne
i overflaten av vannet blir det dannet flere hydrogenbindinger enn under vann
likt løser likt!
polar løsemidler løser polare molekyler
upolare molekyler blir løst i en upolar løsning
vann som løsemiddel
homogen
det ene stoffet er et løsemiddel
løsning bestående av to eller flere stoffer som er blandet jevnt i løsningen
heterogen
blandingen består også av to eller flere stoffer, men de er ikke blandet jevnt tmed løsningen
upolare molekyler som har wan der wahls binding seg i mellom vil ikke kunne reagere med vann og løses opp fordi hydrogen bindingene i vann er de sterkeste av svake
Hydrogen
overflatespenning
massetetthet
temperatur
varmt vann har mindre massetetthet enn kaldt vann
ved 4 grader har vann størst massetetthet
om sommeren er det kalde vannet nederst på bunnen
løsnings prosess
alle bindinger mellom gitte stoffer i en løsning må brytes
vann trekker til seg stoffer som er ladet
vann spinner seg rundt det nye stoffe som kommer i løsningen
mettet og umettet: evnen til løsningen til hvor mye av et gitt stoff den kan ta opp