по Adrian Vera 5 лет назад
526
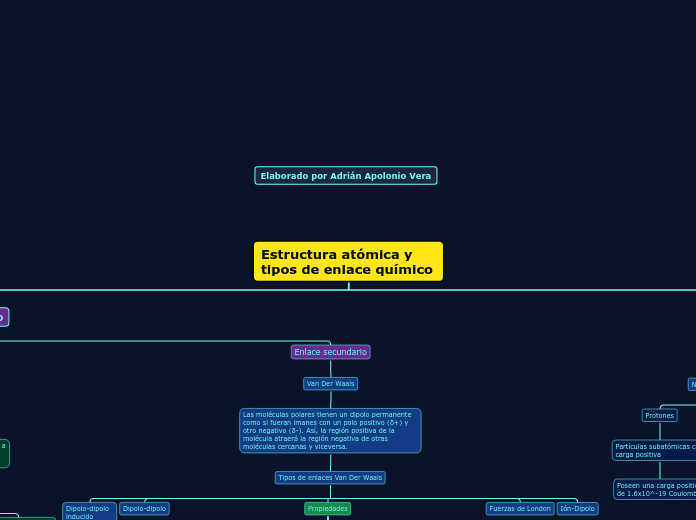
Estructura atómica y tipos de enlace químico
по Adrian Vera 5 лет назад
526

Больше похоже на это
Masa total del número promedio de protones y neutrones en el átomo en unidades de masa atómica
Sus unidades son gramos/mol
El número de Avogadro NA=6.022 x10^23 átomos/mol es el número de átomos o moléculas en un mol
Número de protones en cada átomo
Orbitan el núcleo del átomo y tienen carga negativa
Posee una carga negativa de 1.6x10^-19 Coulombs
Neutrones
Partículas subatómicas con carga neutra
Protones
Partículas subatómicas con carga positiva
Poseen una carga positiva de 1.6x10^-19 Coulombs
Las moléculas polares tienen un dipolo permanente como si fueran imanes con un polo positivo (δ+) y otro negativo (δ-). Así, la región positiva de la molécula atraerá la región negativa de otras moléculas cercanas y viceversa.
Tipos de enlaces Van Der Waals
Ión-Dipolo
Fuerzas de London
Propiedades
Adhesión
Tensión superficial
Viscosidad
Agua H2O
Aumento de los puntos de fusión y ebullición de un compuesto
Dipolo-dipolo
Dipolo-dipolo inducido
Se da entre metal+no metal
Un átomo puede donar sus electrones de valencia a un átomo distinto, llenando la capa externa del segundo átomo.
Solubles en agua y disoluciones acuosas
Estructura cristalina
Sal de mesa NaCl
Sólidos a temperatura ambiente
Ocurre entre 2 o más NO metales
Se forman por medio de la compartición de electrones de valencia entre dos o más átomos.
Altos puntos de fusión
Dureza
Diamante (C)
Resistencia
Se da entre átomos metálicos de un mismo elemento
los átomos ceden sus electrones de valencia para formar un mar de electrones.
Características
Buenos conductores de calor
Poseen alta ductilidad
Buenos conductores de electricidad