по rina de niño 4 лет назад
1113
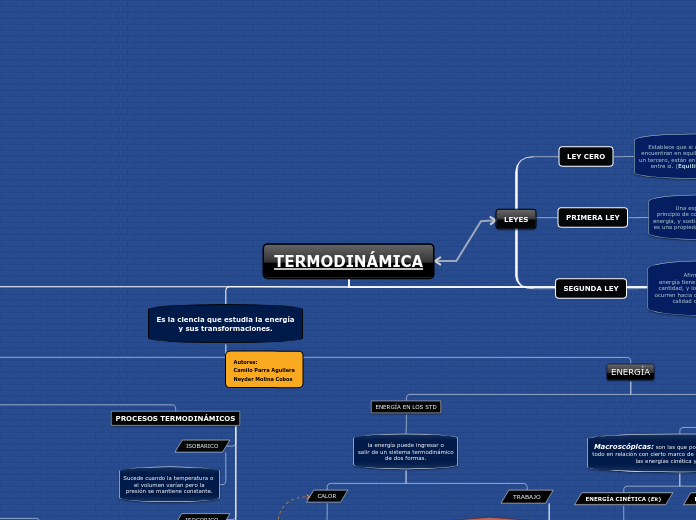
MAPA CONCEPTUAL TERMODINÁMICA
по rina de niño 4 лет назад
1113

Больше похоже на это
Al presentarse una mezcla en el STD se debe tener en cuenta la calidad del gas
X=(masa de gas/masa total)
ECUACION DE ESTADO: Pv=ZRT
Microscópicas: de energía son las que se relacionan con la estructura molecular de un sistema y el grado de la actividad molecular, y son independientes de los marcos de referencia externos.
ENERGÍA INTERNA (U)
Energía sensible: energía necesaria para comenz- zar un cambio de fase.
Energía latente: energía necesaria para elevar la energía de un fluido.
Macroscópicas: son las que posee un sistema como un todo en relación con cierto marco de referencia exterior, como las energías cinética y potencial
ENERGÍA POTENCIAL (Ep)
Ep = m*g*h [kJ]
ENERGÍA CINÉTICA (Ek)
Ek = (1/2)*m*V2 [kJ]
la energía puede ingresar o salir de un sistema termodinámico de dos formas.
TRABAJO
TRABAJO DE FRONTERA MÓVIL Wb = ∫P*dV ----> Ecuacion General Wb = P*ΔV ----> cuando la presión es constante!
TRABAJO DE FLECHA --> W = 2 *π*n*T TRABAJO DE RESORTE --> W = (1/2)*k*Δx TRABAJO POTENCIAL --> W = m*g*h TRABAJO DE EMBOLO ---> W = P*Δv TRABAJO ELÉCTRICO -----> W = V*I*Δt
w = W / m [kJ/kg]
CALOR
q = Q / m [kJ/kg]
calores específicos:
Calor a presión constante:
Cp = (dh/dT)pc
Calor a volumen constante:
Cv = (dv/dT)vc
Estos calores específicos se calculan por tablas y además se requieren para calcular el cambio de la energía interna (ΔU) y el cambio de las entalpías (ΔH).
Donde: ΔU = Cvprom*ΔT [kJ/kg] Δh = Cpprom*ΔT [kJ/kg]
DIABATICO
NO HAY CAMBIO DE ENERGÍA (La energía no atraviesa el sistema)
ISOTERMICO
Este tipo de proceso sucede cuando la temperatura del gas permanece constante.
ADIABATICO
Sucede cuando en el sistema no recibe ni calor ni trabajo. el sistema no transfiere energía con sus alrededores.
ISOCORICO
Este proceso se presenta cuando la presion o la temperatura varían pero el volumen es constante. (Wt = 0)
ISOBARICO
Sucede cuando la temperatura o el volumen varían pero la presión se mantiene constante.
EXTENSIVAS
Propiedades que dependen de la masa
ENERGÍA ESPECÍFICA
*Capacidad para hacer un trabajo* e = E / m [kJ/kg]
VOLUMEN ESPECIFICO
*Volumen por unidad de masa* v = V / m [m3/kg]
INTENSIVAS
Propiedades independientes de la masa
DENSIDAD
*Se define densidad a la masa por unidad de volumen* ρ = m / V [kg/m3]
PRESIÓN
Presion = Fuerza / Área Pmanométrica = Pabs - Patm Pvacío = Patm - Pabs
TEMPERATURA
T(K) = T (°C) + 273.15 T(R) = T (°F) + 450.67 T(R) = 1.8T (K) T(°F) = 1.8T (°C) + 32
SISTEMA CERRADO
MASA CONTROL (La masa no varía, la masa es constante) La energía si puede cruzar puede atravesar la frontera. Para su solución se emplean balances de energía.
FRONTERA MOVIL
Qnetin - Wneout = ΔH
FRONTERA FIJA
Qnetin - Wneout = ΔU
SISTEMA ABIERTO
VOLUMEN CONTROL (La masa varía) Para solución de sistemas abiertos se emplean:
BALANCE DE ENERGÍA
TASA DE ENERGIA POR UNIDAD DE TIEMPO
E_dotin - E_dotout = dESIST/t
Ein - Eout = ΔESIST
BALANCE MASA
FLUJO MASICO
FLUJO VOLUMENTRICO
V_dot=ATVprom
m_dotin - m_dotout = dmSIST/t m_dot = ρ*V_dot
min - mout = ΔmSIST