по Valeria Pérez 4 лет назад
176
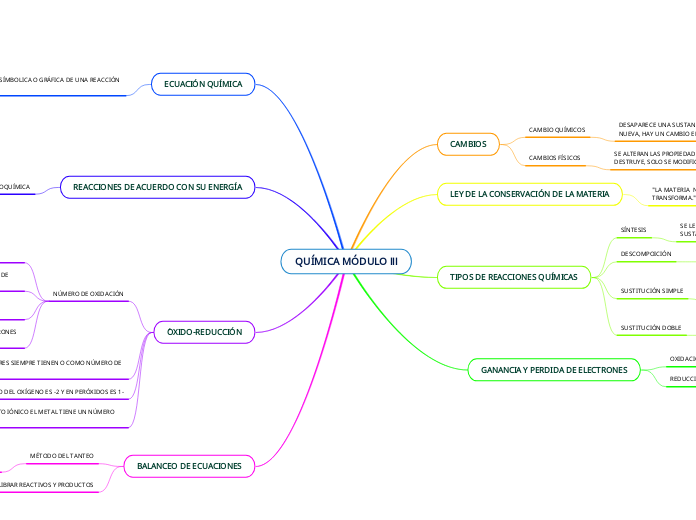
QUÍMICA MÓDULO lll
по Valeria Pérez 4 лет назад
176

Больше похоже на это
ENDÓTERMICAS
ABSORVE CALOR, SI LOS VALORES SON POSITIVOS.
EXÓTERMICAS
SE LIBERA CALOR, SI EL VALOR ES NEGATIVO
SI EL NÚMERO ES NEGATIVO ES PORQUE GANA ELECTRONES
SI EL NÚMERO ES POSITIVO ES PORQUE PIERDE ELECTRONES
AB + CD = AD + BD
ENTRE MÁS A LA DERECHA Y MÁS ARRIBA SE ENCUENTREN MAYOR ES LA AFINIDAD.
AB + C = CB + A
AB = A + B
A + B = AB