по Mario Romero 4 лет назад
221
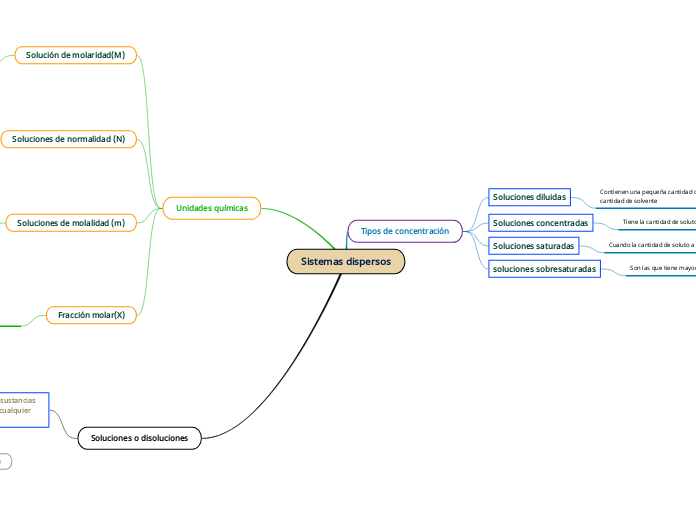
Sistemas dispersos
по Mario Romero 4 лет назад
221

Больше похоже на это
Fracción molar (Xi) = ni (moles de sustancia)/ nt (moles totales de la disolución)
Calcular la fracción molar de cada una de las sustancias de la disolución de: 10 moles de metanol, 1 mol de etanol y 8 moles de agua. nt = moles totales de la disolución = nmetanol + netanol + netanol = 10 + 1+ 8 = 19 xmetanol = nmetanol / nt = 10 / 19 = 0,53 xetanol = netanol / nt = 1 / 19 = 0,05 xagua = netanol / nt = 8 / 19 = 0,42 Podemos comprobar que la solución es correcta ya que la suma de las tres es igual a 1: xmetanol + xetanol + xagua = 0,53 + 0,05 + 0,42 = 1
Molalidad (m) = n (nº de moles de soluto)/ Kilogramos de disolvente
Normalidad (N) = nº EQ (equivalentes-gramo)/ Litros de disolución
Calcular la normalidad de 20 gramos de hidróxido de berilio Be(OH)2 en 700 ml de disolución: Peso molecular del Be(OH)2 = 43 En una disolución el hidróxido de berilio se disocia de la siguiente forma: Be(OH)2 → Be+2 + 2 OH- Equivalente del Be(OH)2 = peso molecular / nº de OH- = 43 / 2 = 21,5 nº de Equivalentes en 20 g de Be(OH)2 = 20 / 21,5 = 0,93 N = nº de Equivalentes / litros de disolución = 0,93 / 0,7 = 1,33 N
Molaridad (M) = n (nº de moles de soluto)/Volumen de disolución
Calcular la molaridad de una disolución que contiene 2,07·10-2 moles de soluto en 50 ml de disolvente: molaridad = M = n / V = 2,07·10-2 moles / 0,05 litros = 0,414 molar
Miel
Salmuera
Café en agua
Una pizca de sal en el agua