по Naiha Zharick Hernández 4 лет назад
523
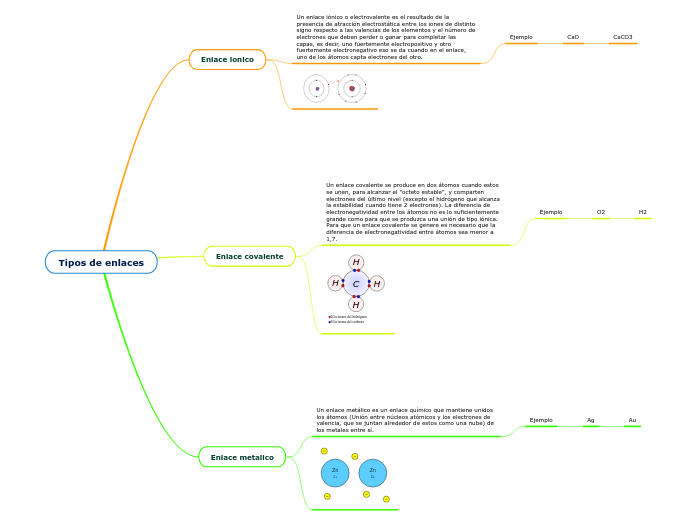
Tipos de enlaces
по Naiha Zharick Hernández 4 лет назад
523

Больше похоже на это
Ag
Au
O2
H2
CaO
CaCO3