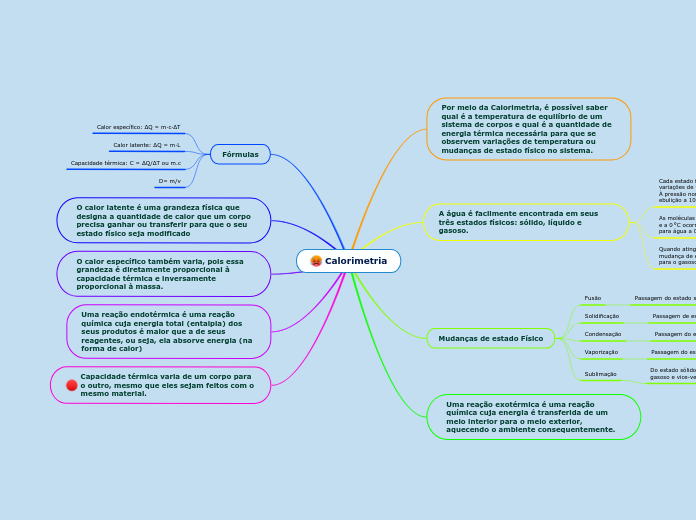
Calorimetria
Por meio da Calorimetria, é possível saber qual é a temperatura de equilíbrio de um sistema de corpos e qual é a quantidade de energia térmica necessária para que se observem variações de temperatura ou mudanças de estado físico no sistema.
A água é facilmente encontrada em seus três estados físicos: sólido, líquido e gasoso.
Cada estado físico da água é possível de acordo com as variações de temperatura e pressão.
À pressão normal (1atm), a água entra em fusão a 0 °C e em ebulição a 100 °C.
As moléculas de água a -1 °C encontram-se em estado sólido e a 0 °C ocorre a mudança (ponto de fusão) de gelo a 0 °C para água a 0 °C.
Quando atinge a temperatura de 100 °C, realiza uma nova mudança de estado (vaporização), passando do estado líquido para o gasoso.
Mudanças de estado Físico
Fusão
Passagem do estado sólido para o líquido.
Solidificação
Passagem de estado líquido para o sólido.
Condensação
Passagem do estado gasoso para o líquido
Vaporização
Passagem do estado líquido para o gasoso
Sublimação
Do estado sólido para o
gasoso e vice-versa
Uma reação exotérmica é uma reação química cuja energia é transferida de um meio interior para o meio exterior, aquecendo o ambiente consequentemente.
Fórmulas
Calor específico: ΔQ = m·c·ΔT
Calor latente: ΔQ = m·L
Capacidade térmica: C = ΔQ/ΔT ou m.c
D= m/v