Clasificación de elementos químicos
Por configuración Electrónica
En la tabla periódica existen dos grandes grupos de elementos a la hora de relacionar la tabla con la configuración electrónica, estos son los representativos y los de transición.
Representativos
Se encuentran ubicados en los grupos 1 y 2 (IA y IIA) y del 13 al 18 (del IA al VIIIA)
De transición
Los de transición están en los grupos del 3 al 12 (del IB al VIIIB)
Correlación entre la configuración electrónica y el tipo de elementos
Bloque
s
- Grupos: 1 (IA) y 2 (IIA) - Tipo de elementos: Representativos
- Configuración electrónica: ns1 y ns2
p
- Grupos: 13 (IIIA) al 18 (VIIIA) - Tipo de elementos: Representativos
- Configuración electrónica: ns2 p1 al 16
d
- Grupos: 3 (IIIA) al 12 (VIIIB)
- Tipos de elementos: De transición
- Configuración electrónica: ns2(n – 1) d1 al 10 f1 al 14
f
- Grupos: Serie de los lantánidos y de los actínidos
- Tipos de elementos: De transición interna
- Configuración electrónica: ns2(n – 1)d1 al 10 f1 al 14
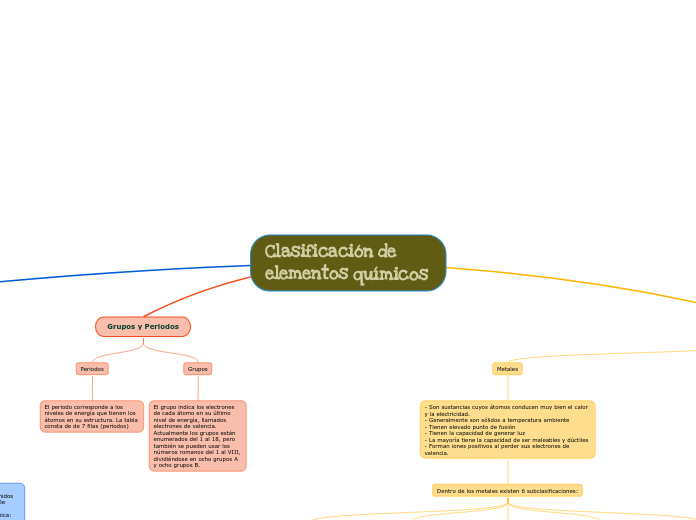
Grupos y Periodos
Periodos
El periodo corresponde a los niveles de energía que tienen los átomos en su estructura. La tabla consta de de 7 filas (periodos)
Grupos
El grupo indica los electrones de cada átomo en su último nivel de energía, llamados electrones de valencia. Actualmente los grupos están enumerados del 1 al 18, pero también se pueden usar los números romanos del 1 al VIII, dividiéndose en ocho grupos A y ocho grupos B.
Tipo de Sustancia
Metales
- Son sustancias cuyos átomos conducen muy bien el calor y la electricidad. - Generalmente son sólidos a temperatura ambiente
- Tienen elevado punto de fusión
- Tienen la capacidad de generar luz
- La mayoría tiene la capacidad de ser maleables y dúctiles
- Forman iones positivos al perder sus electrones de valencia.
Dentro de los metales existen 6 subclasificaciones:
Alcalinos
Se encuentran en el grupo 1 o IA; metales que forman álcalis o soluciones acuosas con un carácter básico.
Alcalinotérreos
Se encuentran en el grupo 2 o IIA. Las soluciones en agua de estos óxidos tienen propiedades alcalinas o básicas.
Metales de transición
Son los elementos que se encuentran en los grupos del 3 al 12 o del IB al VLLLB. Estos metales tiene, en el penúltimo nivel de energía, un subnivel d en donde se encuentran los electrones de valencia, que determinan sus propiedades.
Metales del bloque p
Se encuentran en los grupos del 13 al 16 o del IIA al VIA. Suelen ser algo blandos con puntos de fusión no muy altos.
Metales lantánidos y actínidos
Están en las dos filas inferiores de la tabla periódica, perteneciendo a los grupos 6 (del lantano) y 7 (del actinio). Se distinguen entre sí por la diferencia de electrones que van de 1 al 14.
No metales
- No conducen la corriente eléctrica
- Se pueden encontrar en los tres estados de agregación
- En estado sólido poseen bajo punto de fusión
- En estado líquido poseen bajo punto de ebullición
- Forman iones negativos al ganar electrones en su capa de valencia
- Solo se conocen 19 no metales
Dentro de los no metales se encuentran:
Gases nobles
Son los elementos que se encuentran en el grupo 18 o VIIIA. Son sustancias generalmente monoatómicas.
Halógenos
Son los elementos que se encuentran en el grupo 17 o V11A. Son los más electronegativos y forman fácilmente compuestos con otros elementos.
Los otros no metales
Son los que restan, que serían: el carbono, oxígeno, fósforo, azufre y selenio.
Metaloides
- Presentan propiedades intermedias entre metales y no metales
- Conducen electricidad, pero en menor medida que los metales y mucho más que los no metales.
- Son llamados semiconductores
- Pueden poseer brillo metálico o ser opacos
Hay solo 7 metaloides en la tabla periódica:
- Boro
- Silicio
- Germanio
- Arsénico
- Antimonio
- Telurio
- Polonio