Enlaces Quimicos.
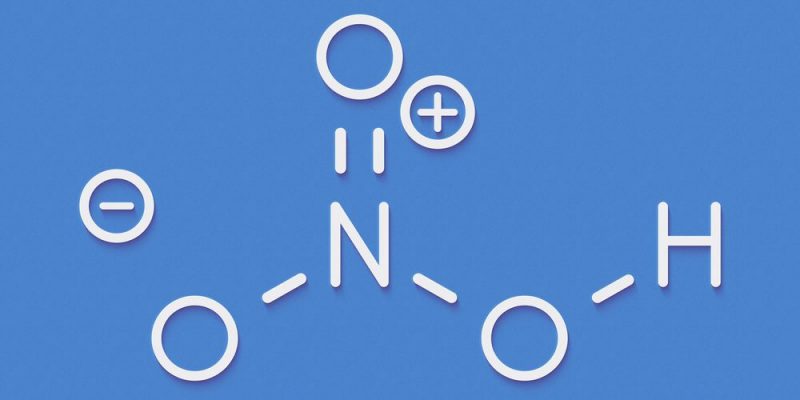
Enlaces Iónicos.
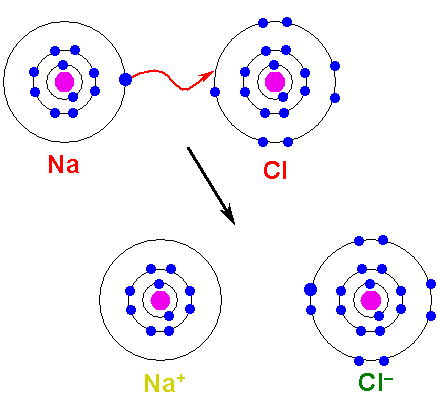
Se da generalmente entre átomos metálicos y no metálicos, fusionados debido a la transferencia permanente de electrones, y produciendo así una molécula cargada electromagnéticamente, conocida como ion.
PROPIEDADES
-Es un enlace fuerte.
-Suelen producir sólidos.
Poseen un alto punto de fusión.
-Solubilidad en agua.
-Tienen una buena conductividad eléctrica una vez disueltos en agua o en solución acuosa, se tornan eficaces conductores de la electricidad dado que contienen partículas móviles con carga (iones).
El enlace iónico es no direccional, es decir su fuerza no se hace presente en una única dirección, sino que se propaga por el espacio en función de las distancias que separan a los iones.
La transferencia electrónica en el enlace iónico se da siempre desde los átomos metálicos hacia los no metálicos, o en todo caso, desde los más electronegativos hacia los menos.
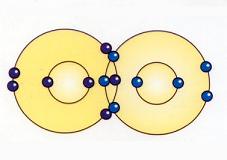
Regla del Octeto.
Se trata de la tendencia que evidencian los átomos de completar su nivel energético con ocho electrones para alcanzar estabilidad.
EXCEPCIONES.
-El oxígeno, el nitrógeno y el carbono son compuestos que no cumplen con la mencionada regla ya que se organizan de manera diferente.
-El aluminio (Al). En concreto, se establece que este consigue la citada estabilidad con la existencia de seis electrones en lo que es la llamada capa de valencia.
El berilio (Be). Es una excepción debido a que su estabilización la halla en cuatro electrones, ya que tiene la capacidad de formar compuestos únicamente con lo que son dos enlaces simples.
El boro (B). Es una excepción porque forma sustancias con lo que son tres enlaces simples, de ahí que no tenga que llegar a los ocho fijados por las mencionada máxima.
Indica que dos átomos iguales, al enlazarse, desarrollan una organización específica para que, al constituirse el enlace por la compartición de los pares de electrones, cada átomo adquiera la estructura de un gas noble. Así, ambos átomos se encontrarán rodeados de ocho electrones en su última capa energética.
Propiedades de los enlaces covalentes.
A temperatura ambiente y a la presión atmosférica normal, los compuestos covalentes se pueden presentar como sólidos, líquidos o gases.
No muestran conductividad eléctrica cuando son disueltos en agua.
Tienen puntos de fusión y ebullición menores que los compuestos iónicos.
Los compuestos covalentes tienden a ser más combustibles.
Muchos compuestos covalentes no son fácilmente solubles en agua. Aquellos compuestos covalentes polares, como el etanol y la glucosa se disuelven bien hasta cierto grado. En cambio, aceites y gasolina no son solubles en agua.

Enlaces Covalentes.
Son las fuerzas que mantienen unidos entre sí los átomos no metálicos
TIPOS DE ENLACE COVALENTE
-No polar
-Polar
-Coordinado o dativo.
Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.
CARACTERISTICAS
-Incluyen enlaces simples, dobles o triples donde 2, 4 o 6 electrones se comparten, respectivamente. -Crean moléculas que pueden ser separadas con menos energía que los compuestos iónicos. -Es más fuerte entre dos átomos con igual electronegatividad.