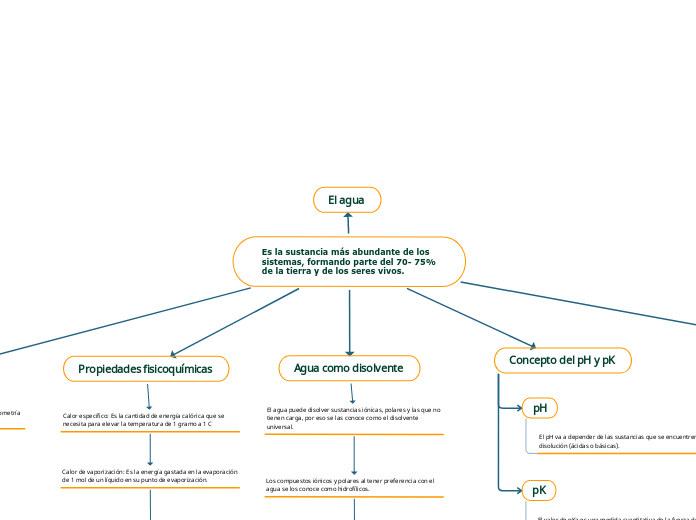
Es la sustancia más abundante de los sistemas, formando parte del 70- 75% de la tierra y de los seres vivos.
El agua
Estructura
Los átomos de hidrógeno y oxígeno tienen una geometría no lineal
Tiene un ´ángulo de 104. 5
El átomo de oxígeno tiene carga negativa y el hidrógeno carga positiva, es decir, un dipolo eléctrico.
Las moléculas de agua se unen mediante enlaces de hidrógeno,. El átomo de oxígeno de una se enlaza a el átomo de hidrógeno de otra.
La molécula del agua se puede unir con 4 moléculas de agua vecinas.
Concepto del pH y pK
pH
El pH va a depender de las sustancias que se encuentren en disolución (ácidas o básicas).
pK
El valor de pKa es una medida cuantitativa de la fuerza de un ácido, cuanto más pequeño es el valor de pKa, más fuerte es el ácido.
Propiedades fisicoquímicas
Calor específico: Es la cantidad de energía calórica que se necesita para elevar la temperatura de 1 gramo a 1 C
Calor de vaporización: Es la energía gastada en la evaporación de 1 mol de un líquido en su punto de evaporización.
Tensión superficial: Es la fuerza de atracción que se da en la superficie de un líquido.
Constante dieléctrica: Propiedad de separar iones de cargas opuestas.
Densidad: El agua líquida es más densa que el hielo a presión y temperatura estándar.
Agua como disolvente
El agua puede disolver sustancias iónicas, polares y las que no tienen carga, por eso se las conoce como el disolvente universal.
Los compuestos iónicos y polares al tener preferencia con el agua se los conoce como hidrofílicos.
Los compuestos no polares son insolubles en agua debido a que carecen de iones, por eso se los denomina hidrófobos.
Ecuación de Henderson
Con esta ecuación podemos calcular la concentración de ácido y base conjugados en todos los puntos de curva de titulación.
pH = pKa + log [A-]/[HA]