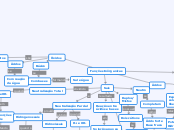
Funções Inôrganicas
Ácidos
Espécie em
solução aquosa
libera H+
Potencial
Hidrogeniônico
Acidez ou
basicidade
pH<7
Ácido
pH>7
pH=7
Neutro
Bases
Substâncias em
solução aquosa
libera OH-
condutores
de corrente
elétrica
Fortes (G1 E G2 -Mg)
Fracas (restante)
Sais
Reação entre
ácidos e bases
Solução aquosa
Cátion e Ânion
H+ e OH-
Neutralização Total
H+ e OH-
Proporções
iguais
Moléculas
de água
Neutralização Parcial
H+ e OH-
Proporções
definidas
1:1
Apenas UMA molécula de água
Hidrogenossais
Quantidade
Moléculas de ácidos
Às de base.
Hidroxissais
Quantidade
Moléculas de base
Às de ácido.
Neutro
Completam
Ácido forte
Base fraca
Ácido fraco
Base forte
Duplos/
Mistos
Dois cátions
Dois ânions
Sais hidratados
Água em sua
constituição
Armazenar água
em seus retículos
Óxidos
Compostos
Por dois
elementos
Oxigênio mais
eletronegativo
Ácidos
Com reação
da água
Básico
Com bases
Sal e água