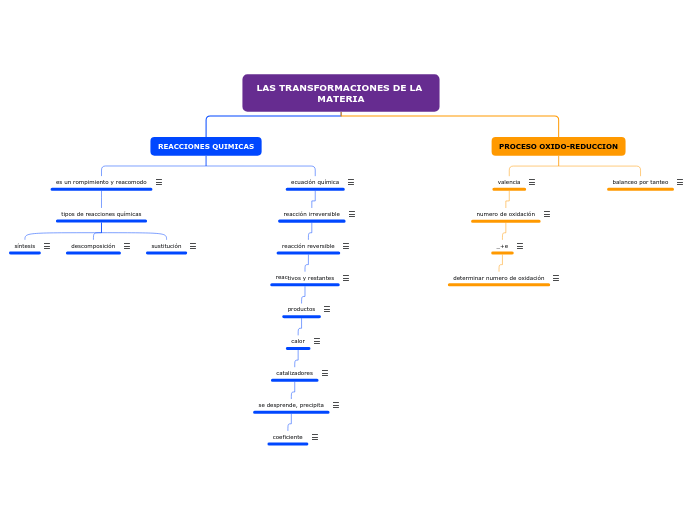
LAS TRANSFORMACIONES DE LA MATERIA
REACCIONES QUIMICAS
es un rompimiento y reacomodo
tipos de reacciones químicas
síntesis
descomposición
sustitución
ecuación química
reacción irreversible
reacción reversible
reactivos y restantes
productos
calor
catalizadores
se desprende, precipita
coeficiente
PROCESO OXIDO-REDUCCION
valencia
numero de oxidación
_+e
determinar numero de oxidación
balanceo por tanteo