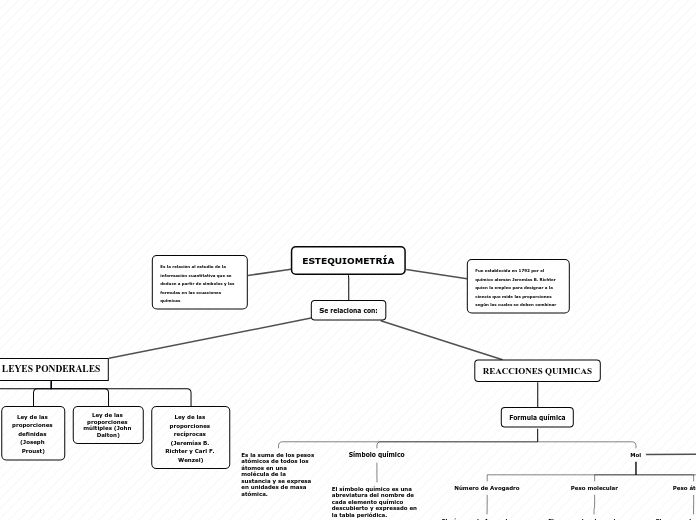
ESTEQUIOMETRÍA
Se relaciona con:
Fue establecida en 1792 por el químico alemán Jeremías B. Richter quien la empleo para designar a la ciencia que mide las proporciones según las cuales se deben combinar
Es la relación al estudio de la información cuantitativa que se deduce a partir de símbolos y las formulas en las ecuaciones químicas
LEYES PONDERALES
Ley de la conservación de la materia (Antoine Laurent de Lavoisier)
Se relaciona con las:
RAZONES ESTEQUIOMÉTRICAS
Masa-masa Masa-mol volumen-volumen masa-volumen mol-volumen
Ley de las proporciones definidas (Joseph Proust)
Ley de las proporciones múltiples (John Dalton)
Ley de las proporciones recíprocas (Jeremías B. Richter y Carl F. Wenzel)
REACCIONES QUIMICAS
Formula química
Es la suma de los pesos atómicos de todos los átomos en una molécula de la sustancia y se expresa en unidades de masa atómica.
Símbolo químico
El símbolo químico es una abreviatura del nombre de cada elemento químico descubierto y expresado en la tabla periódica.
Mol
Número de Avogadro
El número de Avogadro se entiende al número de entidades elementales (es decir, de átomos, electrones, iones, moléculas) que existen en un mol de cualquier sustancia. Na=6,022×10²³
Peso molecular
El peso molecular es la suma de las masas atómicas de todos los átomos de una molécula de un compuesto específico
Peso átomico
El peso molecular de un compuesto químico es la suma de los pesos atómicos de los elementos que constituye la molécula.
Volumen molar
El volumen molar es el espacio ocupado por un mol de una sustancia.