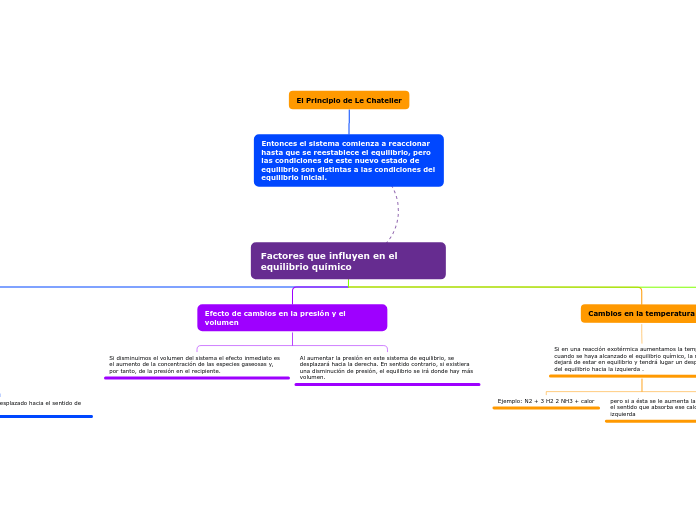
Factores que influyen en el equilibrio químico
Efecto de la Concentración: Adición o eliminación de un reactivo o producto
El aumento de la concentración de cualquier sustancia, dará lugar a que la reacción en equilibrio tienda a consumir parte de la sustancia añadida.
Para restablecer el equilibrio debe aumentar el numerador y disminuir el denominador.
El equilibrio queda ahora más desplazado hacia el sentido de los reactivos.
Efecto de cambios en la presión y el volumen
Si disminuimos el volumen del sistema el efecto inmediato es el aumento de la concentración de las especies gaseosas y, por tanto, de la presión en el recipiente.
Al aumentar la presión en este sistema de equilibrio, se desplazará hacia la derecha. En sentido contrario, si existiera una disminución de presión, el equilibrio se irá donde hay más volumen.
Cambios en la temperatura
Si en una reacción exotérmica aumentamos la temperatura cuando se haya alcanzado el equilibrio químico, la reacción dejará de estar en equilibrio y tendrá lugar un desplazamiento del equilibrio hacia la izquierda .
Ejemplo: N2 + 3 H2 2 NH3 + calor
pero si a ésta se le aumenta la temperatura, se desplazará en el sentido que absorba ese calor, es decir de derecha a izquierda
Efecto de un catalizador
Los catalizadores son sustancias que aceleran las reacciones químicas. El único efecto es hacer que el equilibrio se alcance más rápidamente.