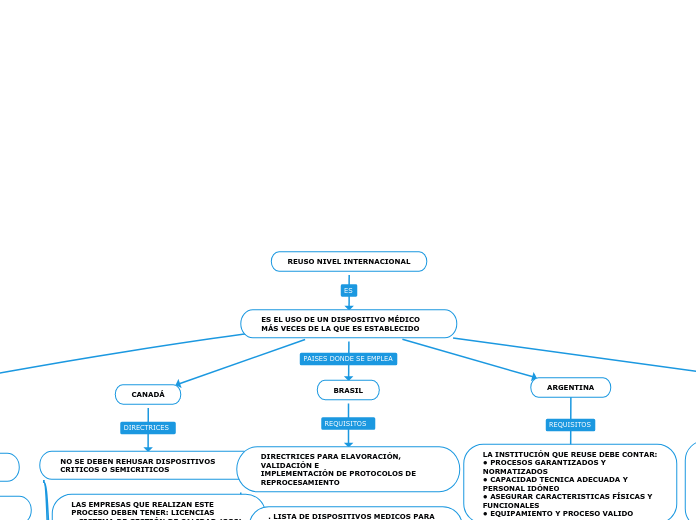
REUSO NIVEL INTERNACIONAL
ES EL USO DE UN DISPOSITIVO MÉDICO MÁS VECES DE LA QUE ES ESTABLECIDO
ESTADOS UNIDOS
REALIZAR UNA LISTA DE DISPOSITIVOS QUE SE REHUSAN COMUNMENTE
ESTABLECER UNA LISTA DE RIESGOS AL SER REHUSADO DICHO DISPOSITIVO
UTILIZAR FACTORES DE RIESGO PARA CATEGORIZAR AL INSTRUMENTO
LOS MATERIALES A REHUSAR DEBEN CUMPLIR CON TODOS LOS REQUISITOS DEL FABRICANTE Y SU TRANZABILIDAD
CANADÁ
NO SE DEBEN REHUSAR DISPOSITIVOS CRITICOS O SEMICRITICOS
LAS EMPRESAS QUE REALIZAN ESTE PROCESO DEBEN TENER: LICENCIAS
• SISTEMA DE GESTIÓN DE CALIDAD (SGC)
• INFORMACIÓN SOBRE RECALL O RETIRO DE PRODUCTOS DEL MERCADO
• NOTIFICACIÓN OBLIGATORIA DE INCIDENTES
• INFORME SOBRE CAULQUIER CAMBIO A LA INFORMACIÓN DE LA SOLICITUD DE LICENCIA
EN ESTE PAÍS SOLO SE HA AUTORIZADO EL REHUSO DE LA MANGA DE COMPRESION NEUMATICA NO INVASIVA
BRASIL
DIRECTRICES PARA ELAVORACIÓN, VALIDACIÓN E
IMPLEMENTACIÓN DE PROTOCOLOS DE REPROCESAMIENTO
. LISTA DE DISPOSITIVOS MEDICOS PARA UN SOLO USO, A LAS CUALES ESTA PROHIBITADO EL REPROCESAMIENTO:AGUJAS CON COMPONENETES
• UNIDAD LAPAROSCOPIA
•ESCALPELOS DESECHABLES CON CUCHILLA FIJA AL MANGO
• BOMBA CENTRÍFUGA DE SANGRE
ARGENTINA
LA INSTITUCIÓN QUE REUSE DEBE CONTAR:
• PROCESOS GARANTIZADOS Y NORMATIZADOS
• CAPACIDAD TECNICA ADECUADA Y PERSONAL IDÓNEO
• ASEGURAR CARACTERISTICAS FÍSICAS Y FUNCIONALES
• EQUIPAMIENTO Y PROCESO VALIDO
UNIÓN EUROPEA
CONSIDERA EL PROCESADOR COMERCIAL COMO UN FARICANTE QUE TIENE TODA LA RESPONSABILIDAD LEGAL PARA EL FUNCIONAMIENTO DE UN DISPOSITIVO MEDICO REPROCESADO
OBLIGA UNA AUDITORIA Y CERTIFICACION DEL FABRICANTE SEGÚN LA NORMATIVA DEL MARCO CE.