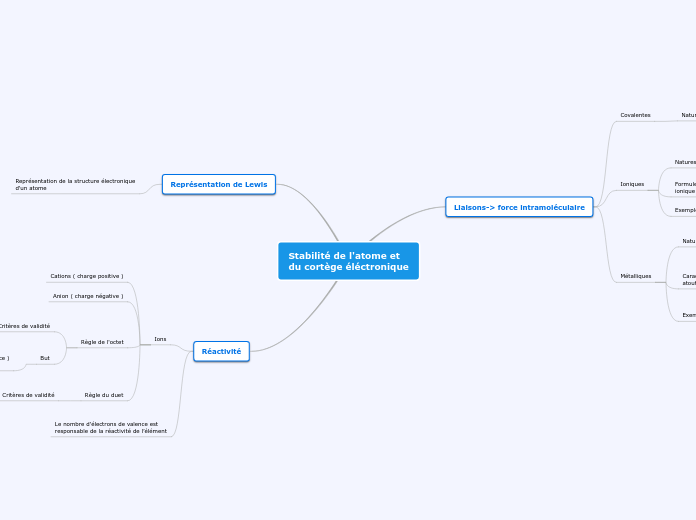
Stabilité de l'atome et
du cortège éléctronique
Liaisons-> force intramoléculaire
Covalentes
Nature des liaisons
Atomes liées en partageant électrons de
valence pour avoir un configuration
électronique identique à celles des gaz nobles
Liaisons stables
Exemple
CO2 -> O=C=O ( représentation de Lewis )
Ioniques
Natures des liaisons
Attraction électrostatiques entre deux ions
de charges opposé
Formule d'un composé
ionique neutre
Total des charges positives des cations = Total des charges négatives des anions
Exemple
Na+Cl-
Métalliques
Nature des liaisons
Ions solides combinés dans les solides de cristallin
avec des électrons de valence mobiles libres.
Libres de bougés car si un s'éloigne
un autre prend sa place
Caractéristiques et
atouts
Brillants
Malléables
Ductiles
Conduisent la chaleur
Conduisent l'électricité
Plus faible que les deux autres liaisons
Exemple
H-F ( représentation de Lewis )
Représentation de Lewis
Représentation de la structure électronique
d'un atome
Réactivité
Ions
Cations ( charge positive )
Anion ( charge négative )
Règle de l'octet
Critères de validité
On dit que l'octet est satisfait si :
Si un atome a 8 électrons de valence
dans sa couche externe
But
Avoir une configuration électronique
d'un gaz noble ( 8 électrons de valence )
pour être inerte chimiquement.
Règle du duet
Critères de validité
On dit que le duet est satisfait si :
Si un atome a 2 électrons de valence
dans sa couche externe
Le nombre d'électrons de valence est
responsable de la réactivité de l’élément