Legami Chimici
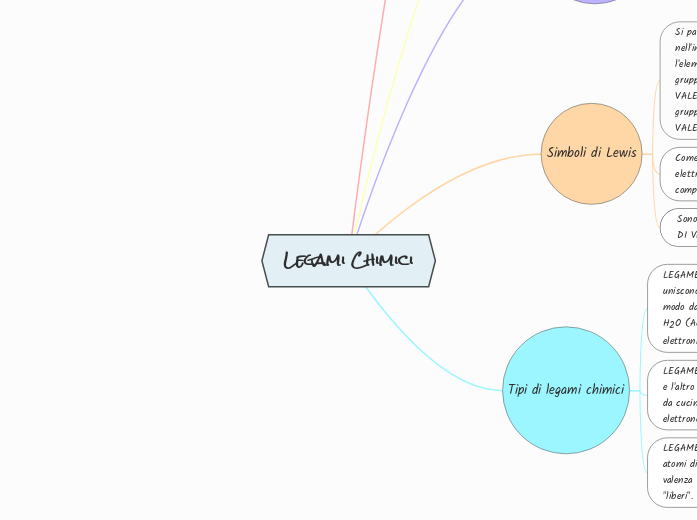
Tipi di legami chimici
LEGAME METALLICO: Si verifica tra atomi di metalli, dove gli elettroni di valenza sono condividi in tanti elettroni "liberi". Esempio Cu (Rame)
LEGAME IONICO: 1 atomo cede elettroni e l'altro li prende. Esempio NaCl (Sale da cucina) Il sodio (Na) cede un elettrone al cloro (Cl) Per formare NaCl
LEGAME COVALENTE: 2 atomi si uniscono per condividere elettroni in modo da completare l'ottetto. Esempio: H2O (Acqua): l'ossigeno condivide 2 elettroni con 2 atomi di idrogeno
Simboli di Lewis
Sono rappresentazioni degli ELETTRONI DI VALENZA
Come si rappresentano? Si disegna un elettrone per ogni lato e poi si va a completamento.
Si parte dalla tavola periodica. Consiste nell'individuare il gruppo a cui appartiene l'elemento. Tutti gli elementi del 1° gruppo avranno un ELETTRONE DI VALENZA; tutti gli elementi del 2° gruppo avranno due ELETTRONI DI VALENZA e così via fino a 8.
Elettroni di Valenza
Importanza: determinano la reattività e la stabilità di un atomo
Definizione: Sono gli elettroni più esterni di un atomo, quelli che partecipano ai legami chimici
Regola dell'Ottetto
L'obiettivo è quello di raggiungere una configurazione stabile come quella dei GAS NOBILI
Come si ottiene?
Cessione o ricezione di elettroni (LEGAME IONICO)
Condivisione di elettroni (LEGAME COVALENTE)
Gli atomi tendono a "prendere" o a "dare" elettroni per avere 8 elettroni nel loro guscio esterno (tranne l'idrogeno che ne ha 2)
DEFINIZIONE: Un legame chimico è la forza che tiene insieme gli atomi in una molecola
I GAS NOBILI hanno già l'ottetto completo
Lo scopo è far sì che gli atomi si "uniscono" per ottenere una configurazione stabile, completando la regola dell'ottetto (avere 8 elettroni)