Actividad Evaluable 1
Materia
Cambios de Estado
Se producen
principalmente por
cambios en la
temperatura, cuando
esta aumenta o disminuye.
Estados de la Materia
Sólido
Líquido
Gas
Plasma
Condensado de Bose-Einstein
Sustancias Puras
Compuestos
La proporción de sus componentes es fija y tienen propiedades específicas.
Elementos
Cambios de la Materia
Físicos
Químicos
Propiedades de la Materia
Físicas
Intensivas
Químicas
Extensivas
Mezclas
Homogéneas
Formadas por dos o más sustancias puras que conservan su
identidad. La proporción de sus componentes es variable.
Las mezclas pueden separarse por métodos físicos:
Filtración
Destilación
Evaporación
Decantación
Heterogéneas
La materia es todo lo que tiene masa y ocupa un lugar en el espacio.
Energía
Capacidad de la materia para realizar un trabajo, o de provocar cambios a su alrededor.
Tipos de Energía
Nuclear
Luminosa
Química
Mecánica
Potencial
Cinética
Eléctrica
Calorífica
Átomo
Número, masa y carga
Número atómico (Z): Número de protones en un átomo.
Número de masa (A): Suma de protones y neutrones.
Carga: Diferencia entre protones y electrones.
Estructura del Átomo
Todos los átomos están formados por tres partículas fundamentales:
Electrones: Partículas negativas.
Neutrones: Partículas sin carga.
Protones: Partículas positivas.
Aportaciones Adicionales
James Chadwick (1891-1974)
Robert A. Millikan (1868-1953)
Eugen Goldstein (1850-1930)
Modelos Atómicos
Arnold Sommerfeld (1868-1951)
Niels Bohr (1885-1962)
JosephJohn Thomson (1856-1940)
Ernest Rutherford (1871-1937)
John Dalton (1766-1844)
Nombrado así por Demócrito de Abdera (460 a 370 a.C.), quien lo consideró la partícula más pequeña posible
(indivisible) de cualquier material, y específica para cada
uno de ellos.
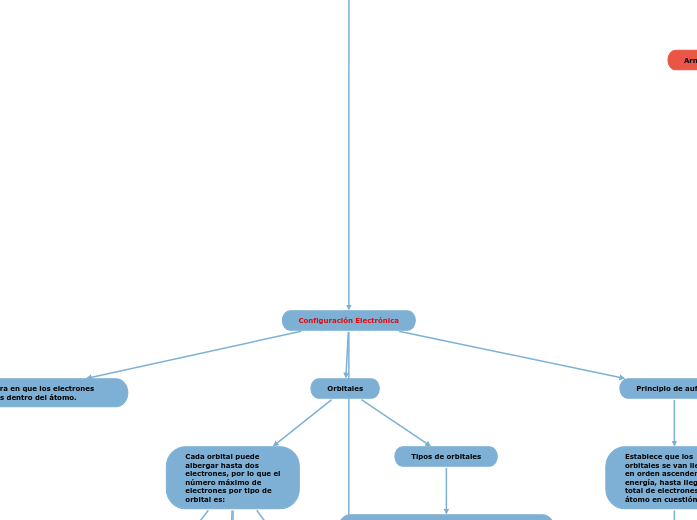
Configuración Electrónica
Describe la manera en que los electrones están organizados dentro del átomo.
Orbitales
Cada orbital puede
albergar hasta dos
electrones, por lo que el
número máximo de
electrones por tipo de
orbital es:
2 en S
6 en P
10 en D
14 en F
Tipos de orbitales
Principio de aufbau
Establece que los
orbitales se van llenando
en orden ascendente de
energía, hasta llegar al
total de electrones del
átomo en cuestión.
Regla de Hund
En un mismo tipo de orbital,
los electrones no se
aparean sino hasta
que cada uno de ellos
tiene un electrón.