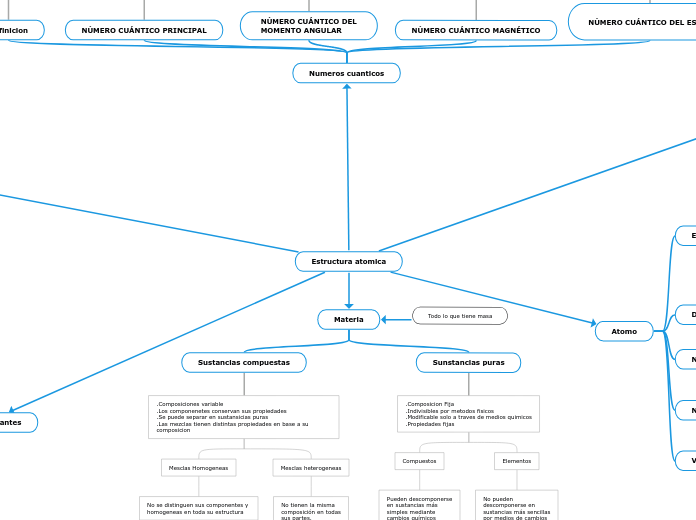
Estructura atomica
Materia
Sustancias compuestas
.Composiciones variable
.Los componenetes conservan sus propiedades
.Se puede separar en sustansicias puras
.Las mezclas tienen distintas propiedades en base a su composicion
Mesclas Homogeneas
No se distinguen sus componentes y
homogeneas en toda su estructura
Mesclas heterogeneas
No tienen la misma
composición en todas
sus partes.
Sus componentes se
pueden distinguir.
Sunstancias puras
.Composicion Fija
.Indivisibles por metodos fisicos
.Modificable solo a traves de medios quimicos
.Propiedades fijas
Compuestos
Pueden descomponerse
en sustancias más
simples mediante
cambios químicos
siempre en proporción
definida.
Elementos
No pueden
descomponerse en
sustancias más sencillas
por medios de cambios
químicos
Atomo
Estructura subatomica
Electrones
Carga negativa y masa despreciable.
orbitan alrededor del nucleo
Protones
Carga positiva y masicos seencuentran
dentro del nucleo
Neutrones
Carga nula y masicos se encuentran del
nucleo
Definicion
Unidad constituyente más pequeña de la materia que tiene las propiedades de un elemento químico y que puede intervenir en una combinación
química
Numero atomico "Z"
Es el numero de protones de un atomo y cuando
el atomo no tiene carga este numero es igual al
de electrones. Este numero es igual para todos
los atomos de un mismo elemento
Numero Másico "A"
Numero formado a partir de la suma de protones
y neutrones, puede variar y si varia solo el numero
masico y no el atomico entonces tenemos un isotopo
Vision cuantica del atomo
Principio de incertidumbre de Heisenberg
Es imposible determinar con exactitud el momento y
la posición de un electrón (o de cualquier otra
partícula muy pequeña) en forma simultánea.

Tabla Periodica
Metales
•Las capas externas tienen
pocos electrones, por lo
general 3 o menos.
• Forman cationes (iones
positivos) por pérdida de
electrones.
• Forman compuestos
iónicos con los no metales.
• Estado sólido
caracterizado por enlace
metálico.
No metales
• Las capas externas tienen
4 o más electrones
(excepto H y He).
• Forman aniones (iones
negativos) por ganancia de
electrones (excepto los
gases nobles).
• Forman compuestos
iónicos con los metales y
compuestos moleculares
(covalentes) con otros no
metales.
• Moléculas enlazadas
covalentemente, los gases
nobles son monoatómicos.
Metaloides
• Exhiben algunas
propiedades que son
características tanto de
metales como de no
metales.
• Actúan como
semiconductores,
importantes en los
circuitos electrónicos.
Numeros cuanticos
Definicion
Estos números cuánticos
definen los niveles de
energía de los electrones y
las formas de los orbitales
que describen las
distribución de los
electrones en el espacio.
NÚMERO CUÁNTICO PRINCIPAL
Nivel de energia de un electron, se escriben n
se usan los numeros naturales
NÚMERO CUÁNTICO DEL
MOMENTO ANGULAR
Subnivel de un electron y la forma de su orbital
l y sus valores son de 0 a (n-1)
NÚMERO CUÁNTICO MAGNÉTICO
Designa un orbital de un subnivel y su orientacion
espacial. m y su valores van desde -l≤0≥l
Orientacion del giro y campo magnetico del electron
valore -1/2 a 1/2
Ideas importantes
Estado
Los atomos y las moleculas existen en ciertos estados determinados por la energia que poseen y para pasar a otro estado deben emitir o absorber energia
Luz
Cuando los átomos o moléculas emiten o absorben radiación (luz), modifican su energía. Este cambio de energía está relacionado con la frecuencia o con la longitud de onda de la luz que emite o absorbe. La energía que gana o pierde un átomo al cambiar de estado es igual a la energía del fotón emitido o absorbido durante la transición
Propiedades periodicas
Radio Atomico
• Se define como la mitad de la distancia entre los núcleos de átomos vecinos
Energia de ionizacion
Cantidad mínima de energía necesaria para separar al electrón menos fuertemente unido de un átomo gaseoso aislado para formar un catión.
.png)
Tendencias Propiedades
Afinidad electronica
Cantidad de energía que se absorbe cuando se añade un electrón a un átomo gaseoso aislado para formar un anión.
Electronegatividad
•Es una medida de la tendencia relativa de un átomo a atraer electrones hacia sí mismo cuando está combinado
químicamente con otro átomo