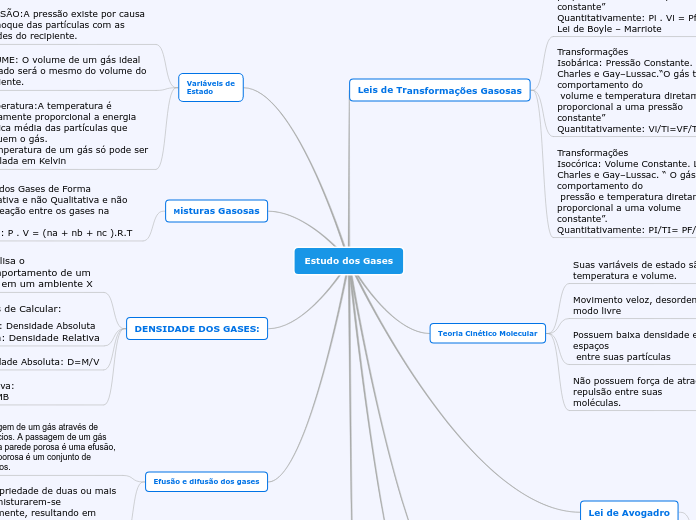
Estudo dos Gases
Leis de Transformações Gasosas
Transformações
Isotérmica: Temperatura
Constante.O gás terá comportamento do volume e pressão inversamente proporcional a uma temperatura constante”
Quantitativamente: Pi . Vi = Pf . Vf
Lei de Boyle – Marriote
Transformações
Isobárica: Pressão Constante. Lei de Charles e Gay–Lussac.“O gás terá comportamento do
volume e temperatura diretamente
proporcional a uma pressão
constante”
Quantitativamente: Vi/Ti=VF/TF
Transformações
Isocórica: Volume Constante. Lei de Charles e Gay–Lussac. “ O gás terá comportamento do
pressão e temperatura diretamente
proporcional a uma volume
constante”.
Quantitativamente: PI/TI= PF/TF
Teoria Cinético Molecular
Suas variáveis de estado são pressão, temperatura e volume.
Movimento veloz, desordenado e de modo livre
Possuem baixa densidade e grandes espaços
entre suas partículas
Não possuem força de atração ou repulsão entre suas
moléculas.
Lei de Avogadro
“Volumes iguais de dois gases diferentes e quaisquer sob mesma condição de temperatura e pressão, contém o mesmo número demoléculas”
Pressão Parcial
Ptotal = Pa + Pb + Pc
Volume Parcial
Baseado na lei de Dalton, Amagat criou a mesma teoria para o volume. Vtotal = Va + Vb + Vc
Equação Geral dos Gases
PI.VI/TI= PF.VF/TF
Variáveis de
Estado
PRESSÃO:A pressão existe por causa do choque das partículas com as paredes do recipiente.
VOLUME: O volume de um gás ideal ocupado será o mesmo do volume do
recipiente.
Temperatura:A temperatura é diretamente proporcional a energia cinética média das partículas que possuem o gás.
A temperatura de um gás só pode ser calculada em Kelvinundefined
Misturas Gasosasundefined
Análise dos Gases de Forma Quantitativa e não Qualitativa e não ocorre reação entre os gases na mistura.
Fórmula: P . V = (na + nb + nc ).R.Tundefined
DENSIDADE DOS GASES:
Analisa o comportamento de um gás em um ambiente X
2 Formas de Calcular:
1ª Forma: Densidade Absoluta
2ª Forma: Densidade Relativa
Densidade Absoluta: D=M/V
Densidade Relativa: DA/DB=MMA/MMB
Efusão e difusão dos gases
Efusão: passagem de um gás através de pequenos orifícios. A passagem de um gás através de uma parede porosa é uma efusão, pois a parede porosa é um conjunto de pequeno orifícios.
Difusão: Propriedade de duas ou mais substância misturarem-se espontaneamente, resultando em soluções, quando colocadas em presença umas das outras.