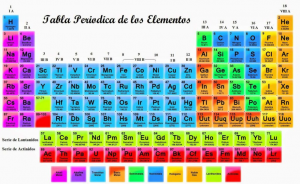
La Tabla Periodica
Historia

En 1869, el químico ruso Dmitri Mendeleev publicó su primera tabla periódica de los elementos organizada en orden creciente de masa atómica.

Mendeleev organizó su tabla en filas horizontales dejando espacios vacíos donde debían incorporar algunos elementos que aún no habían sido descubiertos.
Ley

Es la base de la Tabla Periódica de los Elementos Químicos, la cual postula que las propiedades químicas y físicas de dichos elementos dependen del número atómico.
La ley periódica de Mendeleiev es vista como: "Las propiedades químicas y la mayoría de las propiedades físicas de los elementos son función periódica de sus pesos atómicos".
Clasificación

Se presentan los elementos químicos naturales y sintéticos ordenados según número atómico creciente, y está dividida horizontalmente (periodos) y verticalmente (grupos).
Grupos
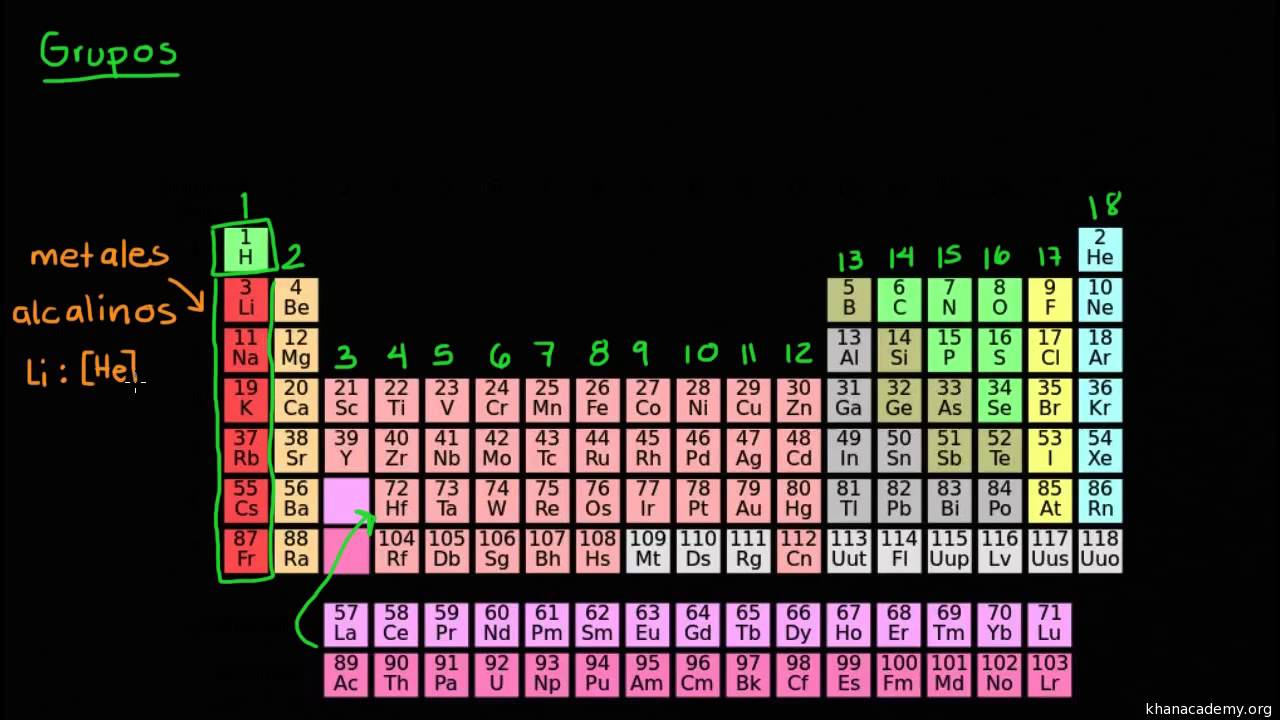
Son las columnas de elementos que la componen, correspondientes a familias de elementos químicos que comparten muchas de sus características atómicas.
Periodos
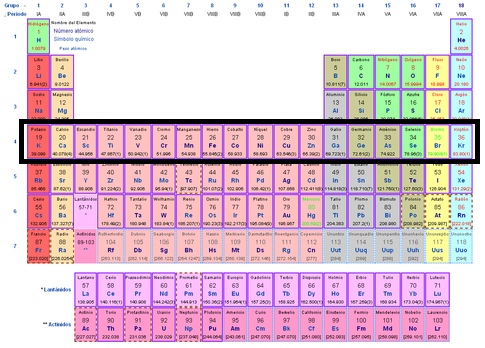
Los Períodos o Familias son las filas horizontales de la Tabla Periódica. Los Períodos representan los niveles energéticos que tiene un átomo. Así, como el hierro (Fe) tiene cuatro niveles energéticos, pertenece por lo tanto al cuarto período.
Propiedades
Son las características de los elementos que están relacionadas por su ubicación en la tabla periódica de acuerdo a su número atómico.
Electronegatividad
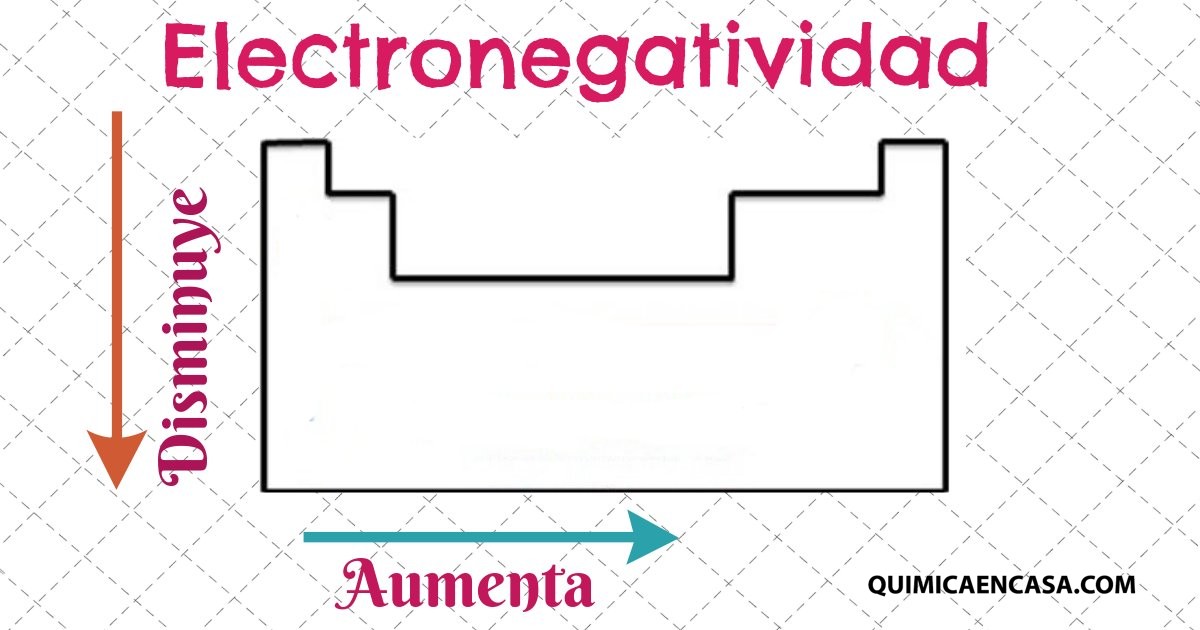
Atracción por los electrones
Radio atómico

Es la distancia entre el centro del núcleo del átomo y el electrón estable más alejado del mismo.
Afinidad electrónica

Es la energía liberada cuando un átomo neutro captura un electrón para formar un ion negativo (anión).

Se ubican por número atómico creciente y las propiedades que presentan se relacionan con ese número.
Potencial de ionización
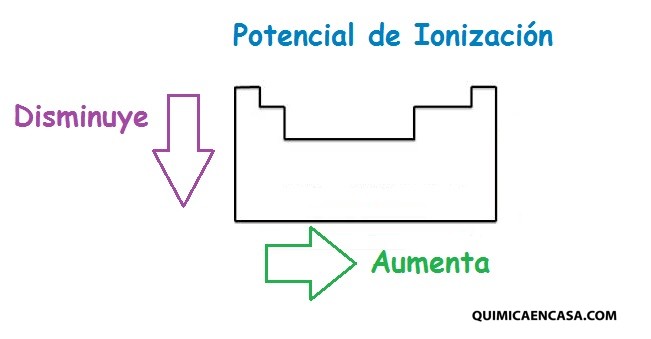
es la energía mínima requerida para separar un electrón de un átomo o molécula
Densidad atómica

Es la relación entre la masa y el volumen
Volumen atómico

Es el cociente entre la masa de un mol del elemento y su densidad, midiéndose normalmente en centímetros cúbicos por mol (c.c./mol).
Gases Nobles
Se ubican en la extrema derecha de la tabla periódica y estos son: helio (He), neón (Ne), argón (Ar), Kriptón (Kr), xenón (Xe) y el radioactivo radón (Rn).

Los gases nobles, son compuestos como el dióxido de carbono o el propano, o mezclas como el aire.
No Metales
Elementos que por lo general son malos conductores del calor y la electricidad.
Entre los no metales, se incluyen el hidrógeno, el carbono, el nitrógeno, el fósforo, el oxígeno, el azufre, el selenio; los halógenos flúor, cloro, bromo y yodo y los elementos de gases nobles.
El oxígeno y los otros elementos de este grupo constituyen una gran parte de la corteza terrestre.

Metales y No Metales
Metales
Tradicionalmente existen seis tipos de metales diferentes, a saber, el oro, la plata, el cobre, el hierro, el estaño y el plomo.
Elementos que son buenos conductores del calor y la electricidad y tienen tendencia a formar iones positivos en los compuestos iónicos.
Familias

Cada familia está determinada primordialmente por el número de electrones de valencia de la última capa.
Las 18 columnas de la tabla periódica son llamadas grupos o familias, la primera familia corresponde a los metales alcalinos y la última o 18 corresponde a los gases nobles.