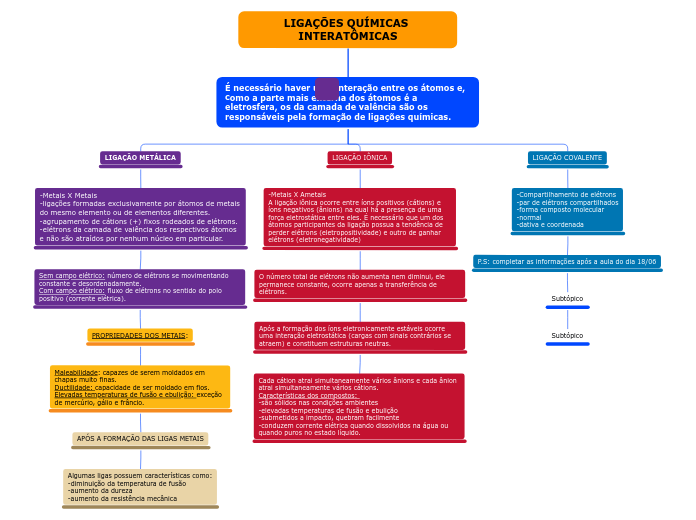
LIGAÇÕES QUÍMICAS INTERATÔMICAS
É necessário haver uma interação entre os átomos e, como a parte mais externa dos átomos é a eletrosfera, os da camada de valência são os responsáveis pela formação de ligações químicas.
LIGAÇÃO METÁLICA
-Metais X Metais
-ligações formadas exclusivamente por átomos de metais
do mesmo elemento ou de elementos diferentes.
-agrupamento de cátions (+) fixos rodeados de elétrons.
-elétrons da camada de valência dos respectivos átomos e não são atraídos por nenhum núcleo em particular.
Sem campo elétrico: número de elétrons se movimentando constante e desordenadamente.
Com campo elétrico: fluxo de elétrons no sentido do polo positivo (corrente elétrica).
PROPRIEDADES DOS METAIS:
Maleabilidade: capazes de serem moldados em chapas muito finas.
Ductilidade: capacidade de ser moldado em fios.
Elevadas temperaturas de fusão e ebulição: exceção de mercúrio, gálio e frâncio.
APÓS A FORMAÇÃO DAS LIGAS METAIS
Algumas ligas possuem características como:
-diminuição da temperatura de fusão
-aumento da dureza
-aumento da resistência mecânica
LIGAÇÃO IÔNICA
-Metais X Ametais
A ligação iônica ocorre entre íons positivos (cátions) e íons negativos (ânions) na qual há a presença de uma força eletrostática entre eles. É necessário que um dos átomos participantes da ligação possua a tendência de perder elétrons (eletropositividade) e outro de ganhar elétrons (eletronegatividade)
O número total de elétrons não aumenta nem diminui, ele permanece constante, ocorre apenas a transferência de elétrons.
Após a formação dos íons eletronicamente estáveis ocorre uma interação eletrostática (cargas com sinais contrários se atraem) e constituem estruturas neutras.
Cada cátion atrai simultaneamente vários ânions e cada ânion atrai simultaneamente vários cátions.
Características dos compostos:
-são sólidos nas condições ambientes
-elevadas temperaturas de fusão e ebulição
-submetidos a impacto, quebram facilmente
-conduzem corrente elétrica quando dissolvidos na água ou quando puros no estado líquido.
LIGAÇÃO COVALENTE
-Compartilhamento de elétrons
-par de elétrons compartilhados
-forma composto molecular
-normal
-dativa e coordenada
P.S: completar as informações após a aula do dia 18/06
Subtópico
Subtópico