FISIOPATOLOGIA DEL TRAUMA RAQUIMEDULAR
LESION MEDULAR PRIMARIA
IMPACTO CON COMPRENSION TRANSITORIA
se presenta en pacientes
con enfermedad degenerativa de la columna
cervical que sufren traumas en hiperextensión
laceracióntransección,
puede deberse a
proyectiles de arma de fuego, luxofracturo
o heridas con elementos corto punzante
Distracción
es el estiramiento forzado de la
médula espinal secundaria a flexión, extensión,
rotación o luxación, es más frecuente en personas
con enfermedad degenerativa de la columna cervical
impacto más
compresión persistente
se observa en
las fracturas con estallido del cuerpo vertebral y
retropulsión de fragmentos de hueso que ejercen
compresión en la médula espinal.
El trauma mecanica inicial
influye fuerzas de tracción y compresión
causando lesiones penetrantes, distensiones o desgarros en el tejido, neurales y estructuras vasculares
el impacto inicial produce el desarrollo de una hemorragia que altera al flujo sanguíneo que produce infartos locales por hipoxia e isquemia
siendo nocivo en la sustancia gris, debido a su requerimiento metabólico y diferencias en la irrigación.
las neuronas localizadas en el área sufren alteraciones estructurales y la vaina de mielina disminuye.
esto adicional al edema y los macrófagos presentes en el área, conducen al deterioro de la transmisión nerviosa.
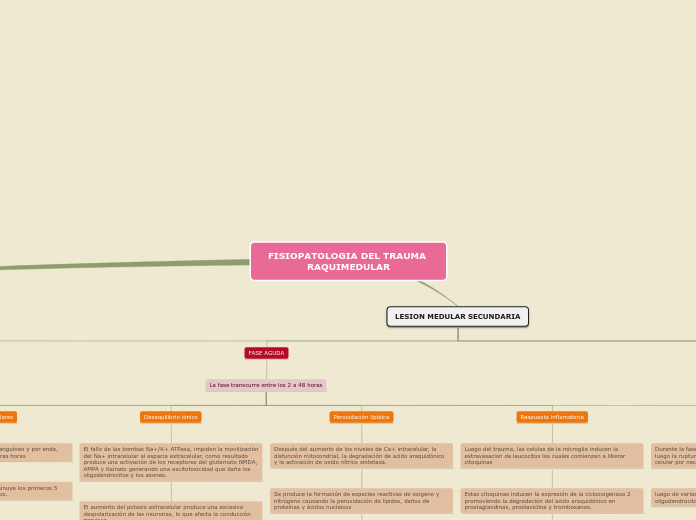
LESION MEDULAR SECUNDARIA
FASE INMEDIATA
La fase transcurre entre 0 a las 2 horas
Las células presentan necrosis por la disrupción mecánica de las membranas y a su vez, una isquemia debido a la disrupción vascular.
la interrupción provoca la presencia de hemorragia en la sustancia blanca, agravando la lesión debido a que se puede extender y afecta a los segmentos adyacentes o distales
FASE AGUDA
La fase transcurre entre los 2 a 48 horas
radicales libre
provoca deterioro enzimático dependiente de fosfolípidos, alteraciones en los gradientes iónicos e incluso lisis de la membrana
además en la hipoperfusión post-traumática presenta una reducción del flujo sanguíneo de la medula espinal conduciendo a la aparición de edema y respuesta inflamatoria.
el estrés oxidativo deshabilita enzimas mitocondriales, produciendo proteínas asociadas al ADN, debido a la nitración de estas e inhiben la ATPasa de N+/K+ induciendo a un colapso metabólico.
por ende la muerte necrótica o apoptótica de la célula.
Mecanismos Vasculares
La lesión provoca reducción del flujo sanguíneo y por ende, isquemia progresiva durante las primeras horas
La perfusión de la materia blanca disminuye los primeros 5 min reestableciéndose los 15 min aprox.
Por el contrario la materia gris presenta múltiples hemorragias y trombosis intravascular haciendo ausencia el flujo durante la primera hora y manteniéndose así las primeras 24 horas.
La hipotensión sistémica puede provocar disminuciones adicionales en el flujo sanguíneo de la ME, con hipertensión inducida que produce hiperemia marcada en los sitios adyacentes.
Posterior al periodo de isquemia, la medula puede presentar un periodo de reperfusión, el cual exacerbar la lesión debido a los radicales libres que contribuyen al estrés oxidativo.
Desequilibrio iónico
El fallo de las bombas Na+/K+ ATPasa, impiden la movilización del Na+ intracelular al espacia extracelular, como resultado produce una activación de los receptores del glutamato NMDA, AMPA y Kainato generando una excitotoxicidad que daña los oligodendrocitos y los axones.
El aumento del potasio extracelular produce una excesiva despolarización de las neuronas, lo que afecta la conducción nerviosa.
Siendo un factor importante en el choque medular.
Peroxidación lipídica
Después del aumento de los niveles de Ca+ intracelular, la disfunción mitocondrial, la degradación de acido araquidónico y la activación de oxido nítrico sintetasa.
Se produce la formación de especies reactivas de oxigeno y nitrógeno causando la peroxidación de lípidos, daños de proteínas y ácidos nucleicos
induciendo alteraciones en el citoesqueleto y organelos que llevan a la lisis y por ende la perdida neuronal.
Respuesta inflamatoria
Luego del trauma, las celulas de la microglia inducen la extravasacion de leucocitos los cuales comienzan a liberar citoquinas
Estas citoquinas inducen la expresión de la ciclooxigenasa 2 promoviendo la degradación del acido araquidónico en prostaglandinas, prostaciclina y tromboxanos.
El exceso de Ca+ citoplasmático activa las fosfolipasas para que a partir de los lípidos de la membrana celular produzcan acido araquidónico.
Apoptosis
Durante la fase aguda el proceso de inflamacion celular y luego la ruptura de la membrana celular llevan a la muerte celular por necrosis de manera inmediata.
luego de varias horas se activa en las neuronas, oligodendrocitos, microglía y astrocitos la cascada apoptótica
FASE SUBAGUDA
La fase tiene una duración aproximada de 2 días a 2 semanas
La respuesta fagocítica aumenta con el fin de lograr una remoción del tejido desbridado en el área de la lesión.
que permite una posible regeneración axonal
Además, la respuesta astrocitaria se presenta de forma tardía debido a una hiperplasia y hipertrofia de la población de astrocitos alrededor de la lesión, que formaran la cicatriz glial.
Que promueve el establecimiento del mantenimiento iónico
FASE INTERMEDIA
Esta fase tiene duración de 2 semanas a 6 meses
hay una maduración de la cicatriz glial producida por la respuesta astrocitaria tardía.
Además, la reacción de los astrocitos permite que se continúe la posible regeneración de los axones afectados
Pero es insuficiente para la recuperación de lesiones severas.
FASE CRONICA
El proceso continua y se extiende a las zonas aledañas a la lesion, las cuales presentan actividad electrica y funciinal deprimida
Lo que se conoce como lesión secundaria y por ende una posterior perdida de la función neuronal
El proceso de desminielizacion inicia a las 24 horas después de la lesión
incrementándose a las dos semanas por el efecto de las células inflamatorias que entran a una segunda fase de migración.
A las tres semanas algunas fibras presentan degeneración walleriana y perdida del diámetro axonal
Las formas inmaduras de oligodendrocitos sanos son capaces de remielinizar algunos axones, además las células de Schwann liberan factores tróficos que colaboran con este proceso.