作者:Zeevii mochii 1 年以前
125
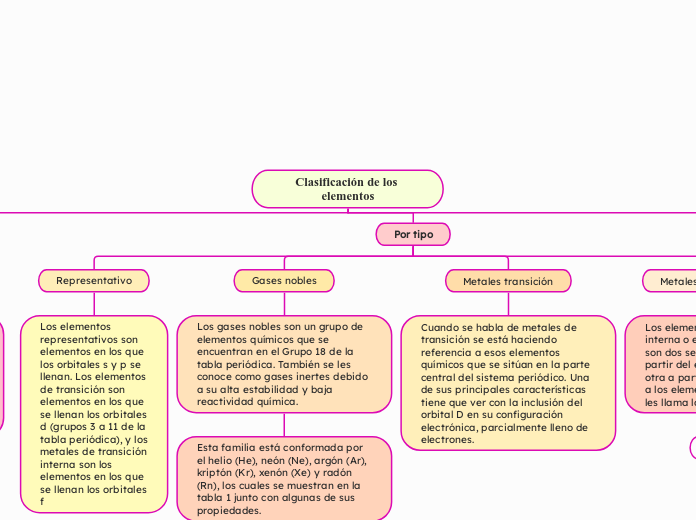
Clasificación de los elementos
作者:Zeevii mochii 1 年以前
125

更多类似内容
El bloque s está formado por los grupos IA y IIA, metales alcalinos y alcalinotérreos, respectivamente. Son metales con brillo, ligeros, blandos y solubles en agua.
Subtópico
Esta familia está conformada por el helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y radón (Rn), los cuales se muestran en la tabla 1 junto con algunas de sus propiedades.
Algunos ejemplos son: Silicio (Si) Germanio (Ge) Arsénico (As) Antimonio (Sb) Telurio (Te) Boro (B)
Los no metales incluyen oxígeno (O), nitrógeno (N), carbono (C), fósforo (P), azufre (S), yodo (I), y flúor (F), entre otros. Los no metales son esenciales para la vida y tienen una amplia variedad de aplicaciones en la industria, la medicina, la agricultura y la tecnología.
Los "metales de transición interna" son un subconjunto específico de los metales de transición que se encuentran en los bloques f y d de la tabla periódica. Estos metales de transición interna son los llamados "lantánidos" y "actínidos".
Actínidos: Estos son los elementos del bloque f que comienzan con el actinio (Ac) y terminan con el lawrencio (Lr), ocupando los elementos de los números atómicos del 89 al 103 en la tabla periódica.
Lantánidos: Estos son los elementos del bloque f que comienzan con el lantano (La) y terminan con el lutecio (Lu), ocupando los elementos de los números atómicos del 57 al 71 en la tabla periódica.
Los metales de transición son un grupo de elementos que se encuentran en los bloques d y f de la tabla periódica. Estos elementos están caracterizados por tener electrones en sus orbitales d y/o f, lo que les confiere propiedades particulares.
Algunos ejemplos comunes de metales de transición son el hierro (Fe), el cobre (Cu), el zinc (Zn), el oro (Au), el platino (Pt), entre otros.
"metales de Tierra (o terrosos)" se refieren a un grupo más amplio de elementos que son generalmente metálicos y se encuentran en la Tierra.
incluye tanto a los metales alcalinotérreos como a otros elementos, como el aluminio (Al), el hierro (Fe), el manganeso (Mn), el titanio (Ti), entre otros.
Es un grupo de elementos químicos que comparten propiedades similares y se encuentran en el grupo 2 de la tabla periódica. Estos elementos tienen una configuración electrónica externa que incluye dos electrones en su nivel de energía más externo
Los metales alcalinotérreos son los siguientes: berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra).
estos elementos tienen un brillo plateado, alta ductilidad, excelente conductividad de la electricidad y el calor, y reaccionan con el agua para formar álcalis.
Los metales alcalinos son litio, sodio, potasio, rubidio, cesio y francio