作者:Luis Ernesto Gómez Sandoval 4 年以前
971
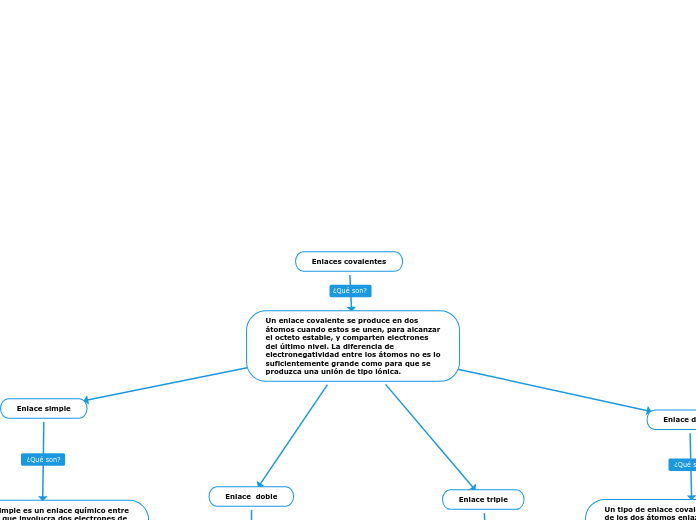
Enlaces covalentes
作者:Luis Ernesto Gómez Sandoval 4 年以前
971

更多类似内容
Enlaces covalentes polares Enlaces covalentes no polares
Se enlazan átomos de un mismo elemento, o de distintos elementos pero con similares electronegatividades, con una diferencia de electronegatividad menor que 0,4. La nube electrónica es atraída con igual intensidad por ambos núcleos y no se forma un dipolo molecular.
Se enlazan átomos de distintos elementos y con diferencia de electronegatividad por encima de 0,5. Así, la molécula tendrá la densidad de carga negativa sobre el átomo más electronegativo, pues este átomo atrae con mayor fuerza los electrones del enlace, mientras que sobre el átomo menos electronegativo quedará una densidad de carga positiva. La separación de las densidades de carga genera dipolos electromagnéticos.