作者:Esther Castellanos 5 年以前
568
Mapa Conceptual CGE
作者:Esther Castellanos 5 年以前
568

更多类似内容
Ruptura heterolítica
Se producen cuando uno de los grupos en que se divide la molécula se queda con los dos electrones, esto provoca que la ruptura del enlace sea asimétrica.
Ruptura Homolítica
-Reacciones radicalarias Son producidas con el rompimiento equitativamente un enlace covalente, en donde cada átomo que se separa conserva un electrón que formaban parte del enlace original.
-Reacciones de aminas: Alquilación y acilación
-Reacciones de transposición: El reordenamiento de los átomos de una molécula hace que se origine otra con estructura distinta.
-Reacciones de sustitución: El átomo o grupo atómico se separa de la molécula reaccionante y es sustituido o desplazado por otro que procede del reactivo atacante.
-Reacciones de Eliminación: Consisten en la pérdida de átomos o grupo de átomos de una molécula con formación de enlaces múltiples o anillos.
-Reacciones por Adición: Son las reacciones en las que los enlaces múltiples se transforman a enlaces sencillos.
Heterocíclicas
Homocíclicas
Aromático
Insaturado
Alicíclico
Saturado
Sencillo y arborescentes
Arborescentes
Saturadas e Insaturadas
Lineales
Saturadas e insaturadas
Isomería configuracional o estereoisomería
-Isomería geométrica: Difieren en la geometría de los grupos de un enlace doble. -Isomería óptica: Difieren en su distinto comportamiento frente a la luz polarizada.
Isomería constitucional o plana
-Isomería de cadena: Poseen el mismo grupo funcional, pero las uniones entre sus carbonos son diferentes. -Isomería de posición: Tienen el mismo grupo funcional pero están colocados en diferente posición dentro de la cadena carbonada. -Isomería de función: Tienen la misma fórmula molecular pero muestran distintos grupos funcionales. -Tautomería: Isómeros se interconvierten continuamente, están los dos presentes en todo momento.
Hibridación sp
1 orbital "s" y 1 orbital "p" se combinan para formar 2 orbitales sp con forma lineal.
Hibridación sp2
1 orbital "s" y 2 orbitales "p" se combinan para formar 3 orbitales híbridos sp2 con forma trigonal.
Hibridación sp3
1 orbital "s" y 3 orbitales "p" se combinan para formar 4 orbitales híbridos sp3 con forma tetraédrica.
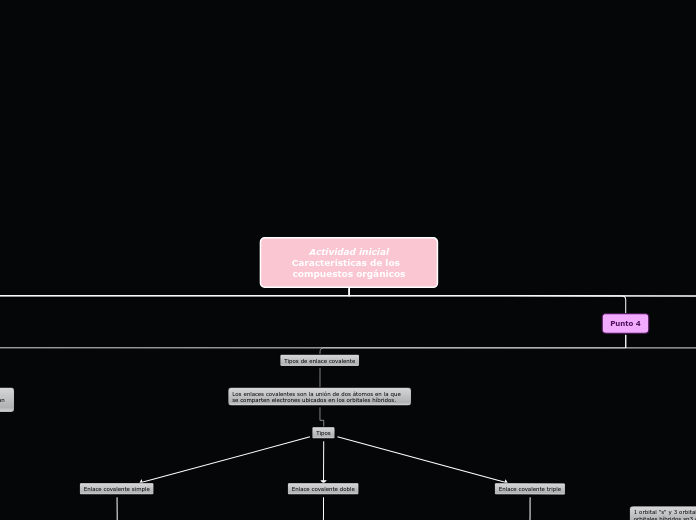
Tipos
Enlace covalente triple
Enlace en el que se comparten tres pares de electrones entre dos átomos.
Enlace covalente doble
Enlace en el que se comparten dos pares de electrones entre dos átomos.
Enlace covalente simple
Enlace en el que se comparte un par de electrones entre dos átomos.
-Sus enlaces son iónicos. -Su volatilidad es baja. -Su combustibilidad es baja. -Su punto de ebullición y fusión son bajos. -Son solubles en agua. -No son sintetizados por los seres vivos. -Son buenos conductores de electricidad.
-Son enlaces covalentes de carbono-carbono o carbono-hidrógeno. -Su volatilidad es alta. -Su combustibilidad es alta. -Tiene punto de ebullición bajo. -Su punto de fusión es bajo. -Tienen alta volatilidad. -Tienen la capacidad de formar cadenas.
El término de química orgánica surgió a finales del siglo XVlll gracias a la "teoría vitalista" planteada por Berzelius.
-En 1776 Lavoisier descubrió que los productos provienen de los animales y vegetales están compuestos por Carbono e Hidrogeno. -En 1807 Berzelius nombró a los compuestos orgánicos. -En 1828 Wöhler demostró que la materia orgánica se podía crear de manera química. -En 1845 Hoffmann demostró la estructura de la anilina. -En 1858 Kekulé y Couper propusieron una nueva teoría estructural y la tetravalencia del carbono.