(Bassel-Duby & Olson, 2006)
Bassel-Duby, R., & Olson, E. N. (2006). Signaling Pathways in Skeletal Muscle Remodeling. Annual Review of Biochemistry, 75(1), 19–37. https://doi.org/10.1146/annurev.biochem.75.103004.142622
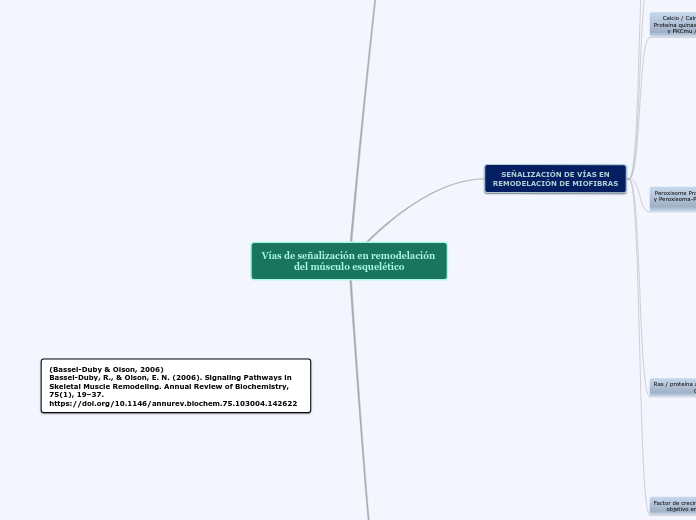
Vías de señalización en remodelación del músculo esquelético
SIGNIFICACIÓN CLÍNICA
Esteroides anabólicos
Un problema oportuno en la remodelación muscular es el uso de andrógenos como agentes anabólicos para aumentar la masa muscular esquelética y reducir la grasa corporal.
El aumento en la masa muscular es un crecimiento hipertrófico
Por lo que se asocian con
Un aumento en el área transversal de miofibras, por lo que en las miofibras tipo I como en las tipo II, no se observa un aumento en el número de miofibras
También no se observa ningún cambio en el número de fibras por unidad de músculo
Sin embargo
Un aumento en el número myonuclear es aparente y se cree que es atribuible a la fusión con células satelitales.
Estudios que determinaron
Los efectos de la testosterona en el rendimiento muscular
Que la administración de testosterona está asociada con un aumento en la potencia y la fuerza de las piernas
Pero
No mostró cambios en la capacidad de fatiga muscular ni cambios en la tensión específica
Por lo que indica que
Los aumentos de fuerza muscular inducidos por la testosterona son reflexivos de un aumento de masa muscular.
Los receptores de andrógenos residen en las células musculares y muy probablemente median la respuesta a los andrógenos.
Los efectos de la testosterona sobre la masa muscular esquelética
Dependen
la administración de dosis suprafisiológicas
Que conducen a un aumento sustancial en el tamaño y la fuerza muscular.
De la dosis
Atrofia muscular
NF-κB
La vía de NF-κB es suficiente para inducir atrofia esquelética severa, parecida a caquexia
También
El bloqueo de la vía NF-κB mejora la atrofia muscular
pero se demostró
La activación de NF-κB en el músculo promueve la proteólisis
Mediador del factor de necrosis tumoral de las citoquinas (TNF) alfa, como respuesta inflamatoria, se activa durante el desuso muscular.
Las miofibras tratadas con TNF más interferón gamma
no logran
mantener actividades contráctiles y muestran reducciones significativas en la expresión de los genes de la cadena pesada tanto de MyoD como de la miosina,
La hipertrofia del músculo esquelético, después de la administración de IGF-1
está mediada por
Aumento en la síntesis de proteínas debido a la fosforilación inducida por Akt, la activación de mTOR
así como
La falta de expresión de MAFbx / atrogin-1 causada por la fosforilación de FOXO inducida por Akt y la exclusión nuclear.
Los factores de transcripción FOXO, sustratos de Akt, inducen la expresión de atrogina-1 / MAFbx
conectando
Los mediadores moleculares de la atrofia y la vía de hipertrofia IGF-1 / PI3K / Akt
El perfil de expresión génica de los músculos extraídos de los modelos de ratón de atrofia múltiple
Tanto MuRF1 como atrogin-1 / MAFbx proteínas son ligasas de ubiquitina E3
son responsable de
La especificidad de sustrato de la conjugación de ubiquitina
como parte de
La vía de proteólisis de ubiquitina-proteosoma dependiente de ATP que puede resultar en una disminución del tamaño de miofibra
Se identificó dos genes
La atrofia muscular F-box (MAFbx) / atrogin-1
El dedo anular del músculo (MuRF) 1
para ser
Regulados en el músculo atrofiado, y la eliminación genética de estos genes parcialmente de la atrofia muscular aliviada.
Las miofibras atróficas tienen un área de sección transversal más pequeña que las miofibras normales y generan una fuerza reducida
sin embargo
No se someten a apoptosis
Retienen la mayoría de las características estructurales del músculo normal
Se define
Disminución en el tamaño de miofibra
Genera una disminución en la masa muscular total
La caquexia es una forma de atrofia muscular
asociada con
Daño al nervio asociado con el músculo
conduce
A una pérdida muscular grave.
Una enfermedad muscular
La sarcopenia es una pérdida crónica de músculo y fuerza
como resultado de
Lesión
Enfermedad
Desuso
Diabetes mellitus tipo 2 y obesidad
Los músculos esqueléticos representan la mayoría de la captación de glucosa
En el músculo esquelético humano, que es estimulado por insulina, el transporte de glucosa se correlaciona con el porcentaje de fibras musculares de contracción lenta.
el músculo esquelético oxidativo de contracción lenta tiene
mayor capacidad de unión a la insulina, así como en actividad de la quinasa
La vía de señalización de la insulina en el músculo esquelético
Es controlado por una serie de
eventos de fosforilación
Que vinculan activaciones iniciales
del receptor de insulina hacia abajo
sustratos
Y finalmente
Translocación de la glucosa transportadora 4 (GLUT4) al plasma de la membrana para unir y captar glucosa
Esto ayuda a reducir la incidencia de la Diabetes tipo II
Estimulada por
La insulina
en
Distrofia muscular
La distrofia muscular de Duchenne (DMD)
La introducción de la calcineurina en el músculo esquelético
No solo activa la expresión de la utrofina
sino que también
Desplaza las fibras rápidas que son más propensas a dañarse
Promover la formación de fibras de tipo I
Se observó que el músculo esquelético de pacientes con DMD
las miofibras rápidas se ven afectadas preferentemente con cambios degenerativos, mientras que las miofibras lentas están relativamente a salvo
La activación de la calcineurina estimula la expresión de la utrofina a través de un sitio NFAT en el promotor de la utrofina
La sobreexpresión de calcineurina activada en el músculo esquelético de ratones mdx.
Carecen del gen de la distrofia
produce
Aumento en la expresión de utrofina, un aumento en las fibras oxidativas y una disminución en la patología
Estrategia para aliviar la DMD implica
La regulación positiva de la utrofina, un homólogo autosómico de la distrofina
Es un trastorno muscular recesivo ligado a X debilitante y potencialmente mortal.
Causado por
Mutaciones en el gen de la distrofina
SEÑALIZACIÓN DE VÍAS EN
REMODELACIÓN DE MIOFIBRAS
Factor de crecimiento similar a la insulina, Akt, y
objetivo en mamíferos de la rapamicina
El músculo esquelético puede adaptarse a la carga de trabajo cambiando el tamaño de miofibra.
El músculo plantar de ratas sometidas a sobrecarga muscular y tratadas con rapamicina
Es un inhibidor de la actividad de mTOR, mostró una activación similar de Akt en respuesta a una mayor carga de trabajo
pero
No mostró ningún cambio en el tamaño o peso de miofibra
Por lo que demuestra
La activación de mTOR es necesaria para el esqueleto Hipertrofia muscular.
Mostraron hipertrofia de mioblastos cultivados en respuesta a un factor de crecimiento similar a la insulina (IGF -1) para depender de una ruta PI3K / Akt / mTOR
Usaron un modelo de sobrecarga funcional de la rata plantar
Los ratones transgénicos que sobreexpresan Akt constitutivamente activo
Mostraron un aumento en la masa muscular debido a un aumento en el tamaño de la fibra muscular
mostraron que
la vía de señalización Akt / objetivo mamífero de la rapamicina (mTOR) se activa durante la hipertrofia
Ras / proteína activada por mitógeno
Quinasa
El ejercicio de alta intensidad y la electroestimulación activan la vía Ras/mitógeno-proteína quinasa activada (MAPK).
La activación de la vía PI3K / proteína quinasa B (Akt) por Ras
Induce
El crecimiento muscular pero no altera la distribución del tipo de fibra, lo que corrobora los estudios realizados con sobreexpresión.
La introducción de Ras exógena activada por MAPK en las fibras musculares regeneradoras denervadas.
Indujo
La expresión de la cadena pesada de la miosina tipo I, pero no afectó el tamaño de la miofibra.
Estudios mostraron que
Las vías dependientes de Ras afectan tanto al tamaño de la fibra como al tipo de fibra.
La ruta Ras / MAPK realiza un cambio en un gen de la cadena pesada de la miosina inducido por las neuronas motoras lentas en la regeneración muscular.
Peroxisome Proliferator-Activated Delta del receptor y Peroxisoma-Proliferador-Activado Receptor Gamma Coactivator-1 alfa
PPAR se asocian con PGC-1
Es posible que la inducción con ejercicio de PGC-1α pueda activar el PPAR delta e inducir la remodelación de miofibras.
El receptor del proliferador activado por peroxisoma (PPAR) delta
Es un importante regulador transcripcional de la quema de grasa en el tejido adiposo
a través de
la activación de enzimas asociadas con la β-oxidación de ácidos grasos de cadena larga y es la isoforma PPAR predominante presente en el músculo esquelético.
Hallazgos
indican
PGC-1α es un factor principal que modula el tipo de fibra muscular
efecto
de la activación de múltiples vías de señalización evocadas durante la remodelación del músculo esquelético.
realizados en
Roedores
Humanos
muestran que
El ejercicio de resistencia induce la expresión de mRNA y PGC-1α de PGC-1α.
La sobreexpresión de PGC-1α en el músculo esquelético
en ratones transgénicos
también mostraron
Aumento en las proteínas involucradas en la oxidación metabólica
mas importante, mostraron
Aumento en el rendimiento muscular y una disminución en la fatiga muscular.
produjo
Aumento de las fibras de tipo I en los músculos vasto blanco y plantar
El coactivador transcripcional peroxisoma-proliferador-receptor activado gamma coactivador-1 (PGC-1α)
El PGC-1α
expresado en grasa parda y músculo esquelético, se enriquece preferentemente en miofibras tipo I
se considera
Regulador de la expresión del gen mitocondrial y se activa la biogénesis mitocondrial y el metabolismo oxidativo
La capacidad oxidativa mejorada y la eficiencia metabólica del músculo esquelético
se observan después del
Entrenamiento físico
se debe a
Un aumento en el contenido mitocondrial que resulta de los cambios en la expresión de los genes que aumentan la biogénesis mitocondrial.
Calcio / Calmodulin-Dependent
Proteína quinasa, proteína quinasa C,
y PKCmu / Protein kinasa D
Translocación del núcleo al citoplasma en respuesta a una estimulación eléctrica de tipo fibra lenta en miofibras aisladas.
además
CaMKII es sensible a la frecuencia de las oscilaciones de calcio
se activa durante el crecimiento hipertrófico y las adaptaciones de resistencia
Los estudios in vitro
demostraron que
la señalización por la proteína quinasa dependiente de calcio / calmodulina (CaMK) da como resultado la fosforilación de HDAC de clase II
Las HDAC de clase II (HDAC4, HDAC5, HDAC7 y HDAC9)
el músculo esquelético y se unen directamente a MEF2
reprimiendo la expresión de los genes dependientes de MEF2
se demostró
que la unión de HDAC de clase II a MEF2 está mediada por 18 aminoácidos
conservados en
las extensiones amino-terminales de HDAC de clase II, un dominio que carece de HDAC de clase I
Calcineurina / Factor Nuclear De
Células T Activadas
La calcineurina
proteína fosfatasa heterodimérica
compuesta
subunidad A catalítica de calmodulina y una subunidad B reguladora de la unión al calcio
se activa mediantes
ondas de calcio sostenidas a baja amplitud y un sensor de actividad contráctil al detectar fluctuaciones de calcio
permiten
que el calcio se una a la calmodulina
Factor potenciador de miocitos-2 y
Histona desacetilasas
Estudios
mostraron
varios estímulos
activación de la proteína quinasa activada por AMP (AMPK)
estrés osmótico
peróxido de hidrógeno
dieron como resultado
la activación de la unión del ADN MEF2D.
adición de insulina
MEF2
es un factor de transcripción enriquecido muscular que se une a una secuencia de ADN rica en A / T
Hay cuatro genes MEF2 de vertebrados MEF2A, -B, -C y -D
MEF2C se expresa más tarde en el programa de diferenciación
La proteína MEF2A aparece a medida que las células entran en la vía de diferenciación
se expresan
durante la embriogénesis y en tejidos adultos
PROPIEDADES DE MIOFIBRAS
Adaptabilidad de miofibras
La capacidad del músculo esquelético para remodelar y cambiar fenotípicamente
La estimulación neuronal reprograma la expresión génica en la miofibra mediante el uso de calcio como un segundo mensajero.
El canal de calcio operado por voltaje o el canal de calcio tipo L (receptor de dihidropiridina) en los túbulos T interactúa con un músculo esquelético sarcoplásmico específico.
El canal de liberación de calcio del retículo o el receptor de rianodina (RyR1)
Esta interacción hace que
RyR1 abra y libere calcio del retículo sarcoplásmico
Otros estudios se basan
En la estimulación eléctrica para modificar la actividad neural suministrada a un músculo de reinervación cruzada al mostrar cambios en las isoformas de miosina
Estudios establecieron que
Los patrones de impulsos específicos producidos por las neuronas motoras
Ejercen
Una influencia fenótipica en los músculos que inervan y que las miofibras sin capaces de remodelar.
Por lo que se puede demostrar mediante experimentos de inervación cruzada.
Que consiste en que
El músculo de contracción lenta (sóleo) es reinervado con fibras nerviosas que son suminstradas al músculo de contracción rápida (flexor digitorum longus)
Contrario a este mecanismo está
La inervación del músculo de contracción rápida con fibras nerviosas que se encuentran normalmente en el músculo sóleo.
Provoca
Una contracción más lenta
Esto produce
Aumento de la velocidad contráctil.
Diversidad de miofibras
Histológicamente el músculo esquelético parece uniforme, está compuesto de miofibras que son heterogéneas
La sobreexpresión de la calcineurina activada en los mioblastos
modula
expresión de los genes de miofibras activando un subconjunto de genes
asociados con
miofibras de tipo I
El ejercicio físico induce cambios en el musculo esquelético al transformar las miofibras en un aumento en el metabolismo oxidativo.
También, induce a transiciones del tipo de fibras
tipo IIb → tipo IId / x → tipo IIa → tipo I
con respecto al:
función contráctil
metabolismo
tamaño
La base de la expresión de la isoforma de la cadena pesada de la miosina específica.
Se detectan diferentes subtipos de miofibras durante la vida embrionaria.
Y se estació
El patrón de tipos de fibra dentro de los grupos musculares principales después del nacimiento.
Las miofibras se clasifican en:
Tipo IIb
Tipo IIb/x
Glicolíticos
Tipo IIa
Denominadas como:
Miofibras de interruptor rápido
Ejercen contracciones rápidas y fatiga rápidamente.
Tipo I
Metabolismo oxidativo
denominadas como:
Fibras de contracción lenta
Ejercen una contracción lenta debido a la actividad de ATPasa asociada con la miosina tipo I.
Las miofibras de interruptor lento son ricas en mitocondrias
Tienen una alta resistencia a la fatiga
Tienen una baja velocidad de acortamiento
Exhiben un metabolismo oxidativo
Tienen más capilares que rodean cada fibra
Las miofibras glicolíticas de contracción rápida (tipo IIb)
Se utilizan para estallidos de contracción y se caracterizan por transitorios de calcio de gran amplitud y niveles de calcio ambientales más bajos (menos de 50nM)
Las miofibras oxidativas de contracción lenta (tipo I)
Participan en eventos contráctiles tónicos sostenidos y mantienen las concentraciones de calcio intracelular en niveles altos (100-300nM)
Estas propiedades de las fibras musculares esqueléticas dependen del patrón de estimulación de los nervios motores
de modo que
La actividad de las neuronas motoras a baja frecuencia (10–20 Hz) promueve el fenotipo de fibra lenta.
mientras que
La activación de las neuronas motoras fásicas a alta frecuencia (100–150 Hz) produce fibras rápidas.
Las fibras oxidatias lentas son necesarias para el mantenimiento de la postura de las tareas que implican resistencia.
Mientras que
Las fibras glucolíticas rápidas son necesarias para los movimientos que involucran fuerza y velocidad.