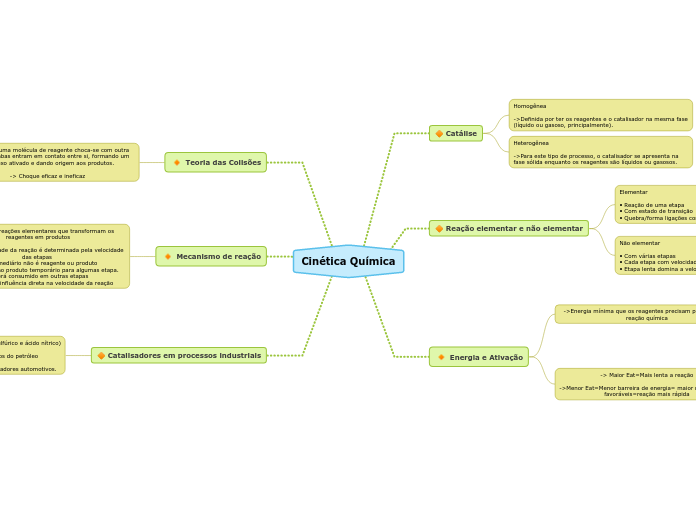
Cinética Química
🔶 Catálise
Homogênea
->Definida por ter os reagentes e o catalisador na mesma fase (líquido ou gasoso, principalmente).
Heterogênea
->Para este tipo de processo, o catalisador se apresenta na fase sólida enquanto os reagentes são líquidos ou gasosos.
🔶 Reação elementar e não elementar
Elementar
• Reação de uma etapa
• Com estado de transição
• Quebra/forma ligações com uma colisão
Não elementar
• Com várias etapas
• Cada etapa com velocidade própria
• Etapa lenta domina a velocidade geral
Energia e Ativação
->Energia mínima que os reagentes precisam para iniciar a reação química
-> Maior Eat=Mais lenta a reação
->Menor Eat=Menor barreira de energia= maior n° de colisões favoráveis=reação mais rápida
Teoria das Colisões
->É quando uma molécula de reagente choca-se com outra molécula, ambas entram em contato entre si, formando um complexo ativado e dando origem aos produtos.
-> Choque eficaz e ineficaz
Mecanismo de reação
Sequência de reações elementares que transformam os reagentes em produtos
* A velocidade da reação é determinada pela velocidade das etapas
* Intermediário não é reagente ou produto
- Surge como produto temporário para algumas etapa.
- Será consumido em outras etapas
- Não tem influência direta na velocidade da reação
Etapa Lenta
- Determinante de velocidade
- 1° etapa da reação
- Mesma lei de velocidade que a lei determinada experimentalmente.
Etapa rápida
- Se inicia no final da Lenta
- Menor energia de ativação
- 2° etapa da reação
🔶 Catalisadores em processos industriais
- Fabricação de ácidos (como ácido sulfúrico e ácido nítrico)
- Hidrogenação de óleos e de derivados do petróleo
- Fabricação de fármacos e em catalisadores automotivos.