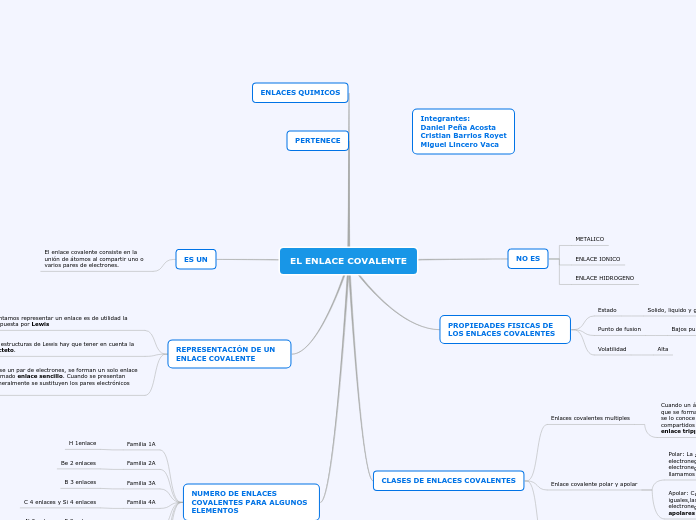
EL ENLACE COVALENTE
NO ES
METALICO
ENLACE IONICO
ENLACE HIDROGENO
PROPIEDADES FISICAS DE LOS ENLACES COVALENTES
Estado
Solido, liquido y gaseoso
Punto de fusion
Bajos puntos d fusion
Volatilidad
Alta
CLASES DE ENLACES COVALENTES
Enlaces covalentes multiples
Cuando un átomo comparte un solo par de electrones, decimos que se forma un enlace covalente sencillo y si comparte mas se lo conoce como enlace covalente múltiple, si los pares compartidos son dos, se llaman enlace doble y si es de tres enlace triple.
Enlace covalente polar y apolar
Polar: La zona que pertenece al átomo de mayor electronegatividad sera el polo negativo y la de menor electronegatividad sera el polo positivo, a esta molécula llamamos polar
Apolar: Cuando las moléculas están formados por átomos iguales,las moléculas no presentan diferencias en su electronegatividad, por lo cual son conocidas como moléculas apolares
Enlace covalente coordinado
Los electrones que se comparten son aportados por uno solo de los átomos que se enlazan. El átomo que aporta el par de electrones se denomina dador y el que lo recibe receptor. Se presenta por medio de una flecha
ENLACES QUIMICOS
PERTENECE
ES UN
El enlace covalente consiste en la unión de átomos al compartir uno o varios pares de electrones.
REPRESENTACIÓN DE UN ENLACE COVALENTE
Cuando intentamos representar un enlace es de utilidad la notación propuesta por Lewis
Para dibujar estructuras de Lewis hay que tener en cuenta la regla del octeto.
Al compartirse un par de electrones, se forman un solo enlace covalente llamado enlace sencillo. Cuando se presentan formulas generalmente se sustituyen los pares electrónicos por guiones
NUMERO DE ENLACES COVALENTES PARA ALGUNOS ELEMENTOS
Familia 1A
H 1enlace
Familia 2A
Be 2 enlaces
Familia 3A
B 3 enlaces
Familia 4A
C 4 enlaces y Si 4 enlaces
Familia 5A
N 3 enlaces y P 3 enlaces
Familia 6A
O 2 enlaces y S 2 enlaces
Familia 7A
F, Cl, Br, e I 1 enlace