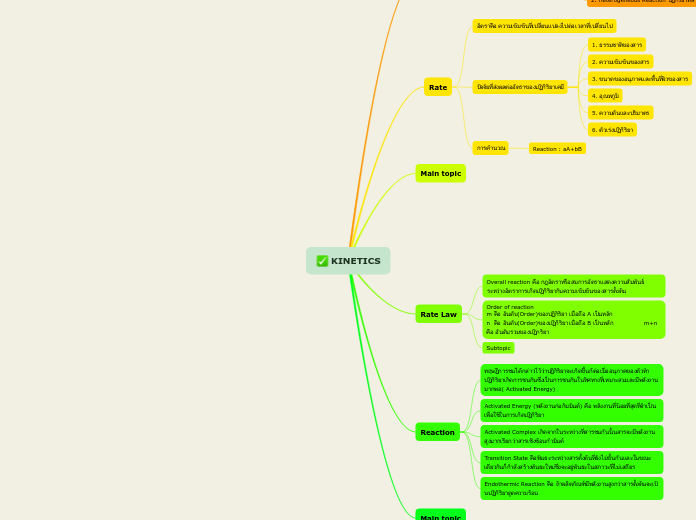
KINETICS
Kinetics คืออะไร ?
จลศาสตร์ เป็นการศึกาาเกี่ยวกับอัตราการเกิดของปฏิกิริยาโดยบอกให้ทราบว่าปฏิกิริยาเกิดขึ้นรวดเร้วเพียงใด
ประเภทของปฏิกิริยา
1. Homogeneous Reaction ปฏิกิริยาที่สารตั้งต้นอยู่ในสภาวะเดียวกัน
2. Heterogeneous Reaction ปฏิกิริยาที่สารตั้งต้นอยู่ต่างสภาวะกัน
Rate
อัตราคือ ความเข้มข้นที่เปลี่ยนแปลงไปต่อเวลาที่เปลี่ยนไป
ปัจจัยที่ส่งผลต่ออัตราของปฏิกิริยาเคมี
1. ธรรมชาติของสาร
2. ความเข้มข้นของสาร
3. ขนาดของอนุภาคและพื้นที่ผิวของสาร
4. อุณหภูมิ
5. ความดันและปริมาตร
6. ตัวเร่งปฏิกิริยา
การคำนวณ
Reaction : aA+bB
Main topic
Rate Law
Overall reaction คือ กฎอัตราหรือสมการอัตราแสดงความสัมพันธ์ระหว่างอัตราการเกิดปฏิกิริยากับความเข้มข้นของสารตั้งต้น
Order of reaction m คือ อันดับ(Order)ของปฏิกิริยา เมื่อถือ A เป็นหลัก n คือ อันดับ(Order)ของปฏิกิริยา เมื่อถือ B เป็นหลัก m+n คือ อันดับรวมของปฏิกริยา
Subtopic
Reaction
ทฤษฏีการชนได้กล่าวไว้ว่าปฏิกิริยาจะเกิดขึ้นก้ต่อเมื่ออนุภาคของตัวทำปฏิกิริยาเกิดการชนกันซึ่งเป็นการชนกันในทิศทางที่เหมาะสมและมีพลังงานมากพอ( Activated Energy)
Activated Energy (พลังงานก่อกัมมันต์) คือ พลังงานที่น้อยที่สุดที่จำเป็นเพื่อใช้ในการเกิดปฏิกิริยา
Activated Complex เกิดจากในระหว่างที่สารชนกันนั้นสารจะมีพลังงานสูงมากเรียกว่าสารเชิงซ้อนกำมันต์
Transition State คือพันธะระหว่างสารตั้งต้นที่ยังไม่ขั้นกันและในขณะเดียวกันก็กำลังสร้างพันธะใหม่ซึ่งจะอยู่พันธะในสภาวะที่ไม่เสถียร
Endothermic Reaction คือ ถ้าผลิตภัณฑ์มีพลังงานสูงกว่าสารตั้งต้นจะเป้นปฏิกิริยาดูดความร้อน