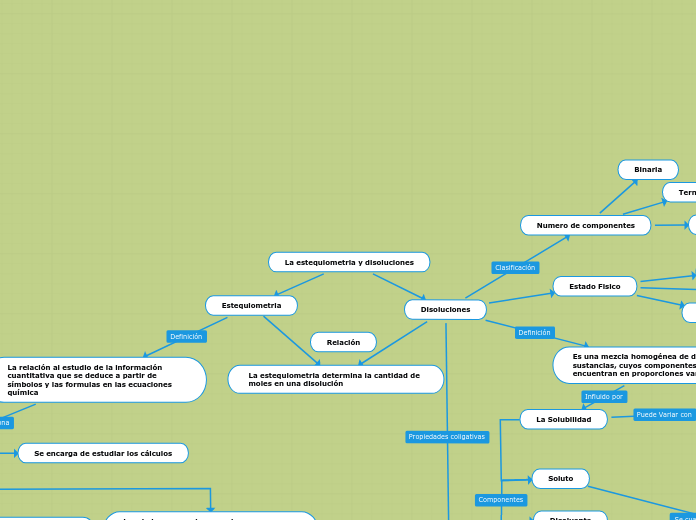
La estequiometria y disoluciones
Estequiometria
La relación al estudio de la información cuantitativa que se deduce a partir de símbolos y las formulas en las ecuaciones química
Leyes Ponderales
Se encarga de estudiar los cálculos
Ley de conservación de la masa (Antoine Laurent De Lavoisier)
La materia no se crea ni se destruye solo se transforma.
Razones estequiometricas
Ley de las proporciones definidas (Joseph Proust)
Cuando se combinan dos o más elementos para dar un determinado compuesto, siempre lo hacen en una relación constante de masas.
Formula mínima o empírica y formula molecular o real
Ley de las proporciones múltiples (John Dalton)
Cuando dos o más elementos se combinan para dar más de un compuesto, una masa variable de uno de ellos se une a una masa fija del otro, y la primera tiene como relación números canónicos e indistintos.
Ley de las proporciones reciprocas (Jeremias Benjamon Richter y Carl Friedrich Wenzel)
Cuando dos elementos se combinan por separado con un peso fijo de un tercer elemento, los pesos relativos de aquellos son los mismos que se combinan entre si
Disoluciones
La estequiometria determina la cantidad de moles en una disolución
Es una mezcla homogénea de dos o más sustancias, cuyos componentes se encuentran en proporciones variables
La Solubilidad
Soluto
Disolvente
Concentración
Diluida
Saturada
Concentrada
% masa, % Volumen
Molalidad
Fracción Molar
Molaridad
Masa de soluto por volumen de disolución
Presión
Temperatura
Punto de Ebullición
Presión de vapor
Punto de congelación
Ósmosis
Numero de componentes
Binaria
Ternaria
Cuaternaria
Estado Fisico
Solidas
Liquidas
Gaseosas