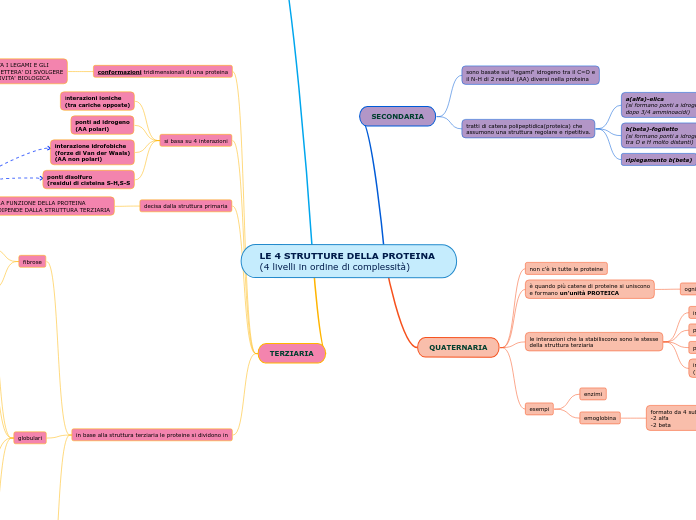
LE 4 STRUTTURE DELLA PROTEINA
(4 livelli in ordine di complessità)
SECONDARIA
sono basate sui "legami" idrogeno tra il C=O e
il N-H di 2 residui (AA) diversi nella proteina
tratti di catena polipeptidica(proteica) che
assumono una struttura regolare e ripetitiva.
a(alfa)-elica
(si formano ponti a idrogeno
dopo 3/4 amminoacidi)undefined
b(beta)-foglietto
(si formano ponti a idrogeno
tra O e H molto distanti)undefined
ripiegamento b(beta)
QUATERNARIA
non c'è in tutte le proteine
è quando più catene di proteine si uniscono
e formano un'unità PROTEICA
ogni catena si chiama SUBUNITA'
le interazioni che la stabiliscono sono le stesse
della struttura terziaria
interazioni ioniche
ponti disolfuro
ponti ad idrogeno
interazione idrofobiche
(interazioni di Van der Waals
esempi
enzimi
emoglobina
formato da 4 subunità
-2 alfa
-2 beta
PRIMARIA
l'ordine viene stabilito dalla sequenza di basi azotate
sequenza ordinata di amminoacidi che formano una proteina
nella struttura primaria è scritta anche la struttura secondaria, terziaria e quaternaria
TERZIARIA
conformazioni tridimensionali di una proteina
RUOTA I LEGAMI E GLI
PERMETTERA' DI SVOLGERE
L'ATTIVITA' BIOLOGICA
si basa su 4 interazioni
interazioni ioniche
(tra cariche opposte)undefined
ponti ad idrogeno
(AA polari)undefined
interazione idrofobiche
(forze di Van der Waals)
(AA non polari)
ponti disolfuro
(residui di cisteina S-H,S-Sundefined
decisa dalla struttura primaria
LA FUNZIONE DELLA PROTEINA
DIPENDE DALLA STRUTTURA TERZIARIA
in base alla struttura terziaria le proteine si dividono in
fibrose
-lunghe e strette
-non sono solubili
-hanno forme regolari
Es: capelli, seta,tendini
le a(alfa)-cheratine si uniscono
in protofibrille
le protofibrille si riuniscono in macrofibrille
può essere ad a(alfa)-elica (capelli),
b(beta)-foglietto (seta)
la struttura terziaria gli conferisce
elasticità e resistenza
globulari
la catena polipeptidica è ripiegata in modo
da formare una struttura compatta
-sono solubili
-struttura varia
gli AA:
idrofili si trovano nella parte esterna e
ionizzati a ph=7
si trovano in coppia con la catena laterale acida
legata alla catena laterale basica.
idrofobici si aggregano all'interno
molte catene laterali delle cisteine
sono legate in coppia a ponti disolfuro
in ambiente acquoso
radicali liberi polari si formano interazioni idrofile
i radicali apolari si aggregano tra loro per sfuggire all'acqua,
formano interazioni di Van der Waals
radicali ionizzati a pH=7 formano legami dipolo-dipolo
si dispongono con gli amminoacidi polari
l'esterno che "proteggono" quelli NON POLARI
che invece si dispongono verso l'interno
possono essere
enzimi
Immunoglobine (anticorpi)
proteine di trasporto
(mioglobina e emoglobina)
di membrana
sono biomolecole legate alle membrane (anche inglobata)
che circondano gli organuli e cellule
sono immerse in un ambiente idrofobico
appunto per questo nella maggior parte dei
casi presenta quasi solo amminoacidi NON POLARI
regolano il passaggio di sostanze
hanno strutture varie