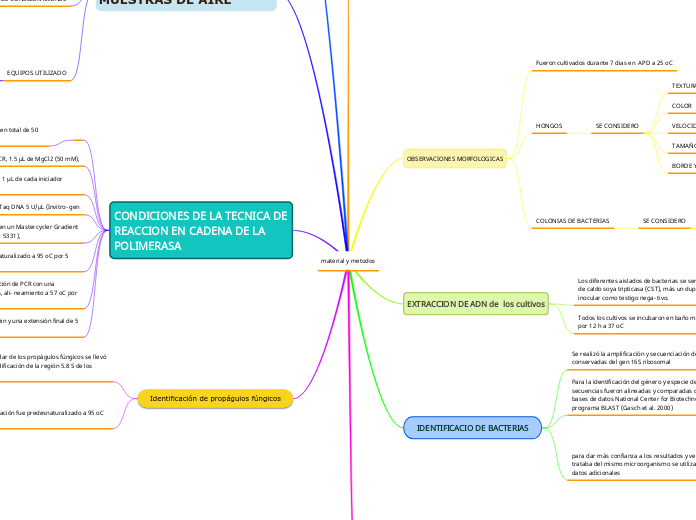
material y metodos
BIOAEROSOLES Y EVALUACIÓN DE LA CALIDAD DEL AIRE EN DOS CENTROS HOSPITALARIOS UBICADOS EN LEÓN, GUANAJUATO, MÉXICO
OBSERVACIONES MORFOLOGICAS
Fueron cultivados durante 7 dias en APD a 25 oC
HONGOS
SE CONSIDERO
TEXTURA
COLOR
VELOCIDAD EDE CRECIIMIENTO
TAMAÑO
BORDE Y ELEVACION
COLONIAS DE BACTERIAS
SE CONSIDERO
COLOR
FORMA
TAMAÑO
BORDES
EXTRACCION DE ADN de los cultivos
Los diferentes aislados de bacterias se sembra- ron en 3 mL de caldo soya tripticasa (CST), más un duplicado del medio sin inocular como testigo nega- tivo.
Todos los cultivos se incubaron en baño maria con agitacion por 12 h a 37 oC
IDENTIFICACIO DE BACTERIAS
Se realizó la amplificación y secuenciación de regiones conservadas del gen 16S ribosomal
Para la identificación del género y especie de las bacterias aisladas, las secuencias fueron alineadas y comparadas con las secuencias ARNr 16S de las bases de datos National Center for Biotechnology Information mediante el programa BLAST (Gasch et al. 2000)
para dar más confianza a los resultados y verificar si se trataba del mismo microorganismo se utilizaron tres bases de datos adicionales
Ribo- somal Database Project II
Greengenes Project
SILVA database project
Las cuatro bases de datos fungieron como herramientas para el alineamiento y clasificación de las secuencias
En la ciudad de león, Guanajuato, México se evaluaron a 2 hospitales, para evaluar la calidad de aire
OBTENCION DE MUESTRAS DE AIRE
Se considero las recomendaciones metodológicas descritas por el Instituto Nacional de Seguridad e Higiene de España
PROTOCOLO UTILIZADO
Guantes desinfetados con una solucionar de etanol al 70%
Piezas de equipo de monitoreo ambiental desinfectadas.
Toallas satirizantes Milliipore
PASOS DE CONSIDERACIONES
Tiempo transcurrido entre la toma de muestras no fue mayor 12 horas.
Se tomaron casetes no abiertos e incubados bajo las mismas condiciones como testigo
EQUIPOS UTILIZADO
Muestreador microbiologico ambiental de la marca Millipore (Sistema M. Air T)
Se basa en el principio de inercia de impacto de Anderson y usa una serie de coladores con cerca de 1000 microperforaciones, lo cual reduce el potencial de colonias sobrelapdas y desecación del medio.
Equipo de captura de aire contenía de medio de cultivos 73 mm de diámetro x 6 mm de alto
CONDICIONES DE LA TECNICA DE REACCION EN CADENA DE LA POLIMERASA
La reacción de PCR se llevó a cabo en un volumen total de 50 μL bajo las siguientes condiciones:
5 μL de 10 × amortiguador PCR, 1.5 μL de MgCl2 (50 mM),
1 μL de solución de dNTP (10 mM), 1 μL de cada iniciador directo y reverso (30 mM)
0.25 μL de polimerasa Platinum Taq DNA 5 U/μL (Invitro- gen
gen). El programa se llevó a cabo en un Mastercycler Gradient (Eppendorf AG, Hamburg, Modelo: 5331),
el templado fue inicialmente desnaturalizado a 95 oC por 5 min
seguido por 30 ciclos de amplificación de PCR con una desnaturalización a 94 oC por 30 s, ali- neamiento a 57 oC por 40 s
primera extensión a 72 oC por 1 min y una extensión final de 5 min a 72 oC
Identificación de propágulos fúngicos
La identificación molecular de los propágulos fúngicos se llevó a cabo mediante la amplificación de la región 5.8 S de los genes ribosómicos.
El programa de amplificación fue predesnaturalizado a 95 oC por 5 min;
35 ciclos a 95 oC por 30 s,
50/55/60 oC por 30 s y 72 oC por 1 min
extensión final a 72 oC por 10 min
RESULTADOS
Hospital 1
concentración de propágulos fúngicos que osciló en un intervalo de 56 a 184 UFC/m3
Subtopic
Hospital 2
el intervalo fue de 32 a 442 UFC/m3,
Respecto a las aerobacterias encontradas en los bioaerosoles analizados
el hospital 1 presentó un intervalo de 40 a 232 UFC/m3
En el hospital 2, fue de 90 a 548 UFC/m3 y el testigo de ambiente exterior presentó 122 UFC/m3
En el hospital 1 la mayor concentración de bacterias fue encontrada en el área de terapia intensiva de niños (232 UFC/m3)
En el hospital 2 la mayor concentración de bacterias fue en el área de terapia intensiva de adultos (448 UFC/m3)