Primera Ley de Termodinámica
Sistema Abierto
Primera Ley de Termodinamica
Qneto-Wneto= ∆H+∆Ec+∆Ep
Qneto= ∑Qentrada-∑Qsalida
∆H=m(h2-h1)
∆Ec=1/2m(vsal^2-vent^2)
∆Ep=mg(z2-z1)
Wneto= ∑Wsalida- ∑Wentrada
Dispositivos
- Toberas y Difusores
Turbinas y compresores
*Características* Q neto≈0. La relación de transferencia de calor para estos dispositivos es pequeña respecto al trabajo del eje, a menos de que haya un enfriamiento deliberado.
W neto≠0. Todos estos dispositivos implican ejes rotatorios que cruzan sus fronteras, por lo que el término trabajo es importante.
ΔEp≈0. El cambio de energía potencial que experimenta un fluido cuando fluye por turbinas, ventiladores, compresores y bombas suele ser muy pequeño y casi siempre se omite.
ΔEc≈0. Las velocidades involucradas en estos dispositivos, con excepción de las turbinas, suelen ser demasiado bajas para producir algún cambio significativo en la energía cinética.
- Intercambios de calor
*Características*
W =0. No implica trabajo.
ΔEc≈0. El cambio de energía cinética, si es que ocurre, es insignificante.
ΔEp≈0. El cambio de la energía potencial es despreciable.
- Válvulas de estrangulamiento
*Características*
Q =0. El proceso es adiabático, ya que no hay ni tiempo suficiente ni área lo bastante grande para que ocurra alguna transferencia de calor efectiva.
W =0. No se efectúa trabajo.
ΔEp=0. El cambio de energía potencial, si es que ocurre, es insignificante.
ΔEc=0. Aun cuando la velocidad de salida es a menudo considerablemente más alta que la velocidad de salida, en muchos casos, este aumento es insignificante.
- Cámara de mezcla
*Características*
Q ≈0. El proceso es adiabático, ya que siempre están bien aisladas.
W =0. No implica trabajo.
ΔEc≈0. El cambio de energía cinética , si es que ocurre, es insignificante.
ΔEp≈0. No hay cambio en la energía potencial o suele ser despreciable.
Sistema Cerrado
Procesos
Isobarico
Es un cambio en el estado de una cierta cantidad de materia en la que la presión permanece constante. Lo que sí cambia es una o más de sus variables de estado. Si se transfiere calor al sistema se realiza trabajo y también cambia la energía interna del sistema.
Fromulas
Reversible
Subtopic
Irreversibe
Subtopic
Isotermico
La temperatura permanece constante en todo momento, o la menos durante su estudio
Es un proceso de compresión donde los factores que varían son la presión y el volumen
Formulas
Reversible
Subtopic
Irreversible
Subtopic
Isometrico
El proceso isocórico es el proceso de compresión por el cual el volumen de un gas permanece constante pero la presión y la temperatura de un gas varían.
Formulas
Reversible
Subtopic
Irreversible
Subtopic
Adiabatico
Un proceso adiabático es aquel en el cual el sistema termodinámico no intercambia calor con su entorno. Un proceso adiabático que es además reversible se conoce como proceso isoentrópico.
Formulas
Reversible
Subtopic
Irreversible
Subtopic
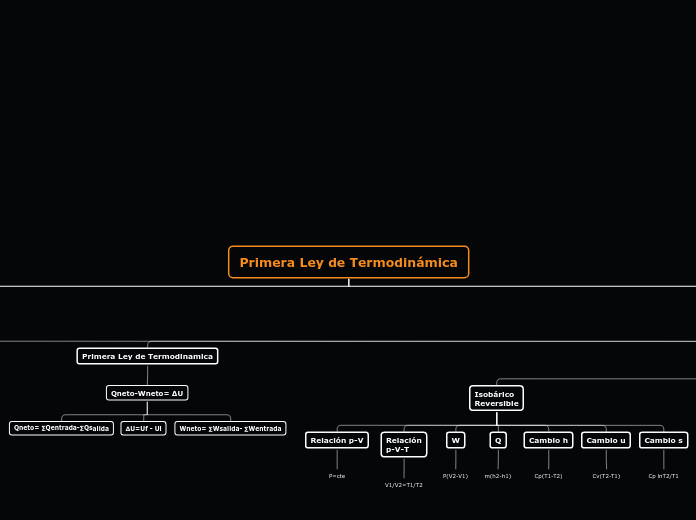
Primera Ley de Termodinamica
Qneto-Wneto= ∆U
Qneto= ∑Qentrada-∑Qsalida
∆U=Uf - Ui
Wneto= ∑Wsalida- ∑Wentrada
Ecuaciones Termodinámicas
Isobárico
Reversible
Relación p-V
P=cte
Relación
p-V-T
V1/V2=T1/T2
W
P(V2-V1)
Q
m(h2-h1)
Cambio h
Cp(T1-T2)
Cambio u
Cv(T2-T1)
Cambio s
Cp lnT2/T1
Isométrico
Reversible
Relación p-V
V=cte
Relación
p-V-T
P1/P2=T1/T2
W
0
Q
m(u2-u1)
Cambio h
Cp(T2-T1)
Cambio u
Cv(T2-T1)
Cambio s
Cv lnT2/T1
Isotérmico
Reversible
Relación p-V
T=cte
Relación
p-V-T
P1/P2=V2/V1
W
P1V1lnV2/V1
Q
P1V1lnV2/V1
Cambio h
0
Cambio u
0
Cambio s
RlnV2/V1
Adiabático
Reversible
Relación p-V
PV^k=c
Relación p-V-T
P1/P2=(V2/V1)^K
W
1/1-K(P2V2-P1V1)
Q
0
Cambio h
Cp(T2-T1)
Cambio U
Cv(T2-T1)
Cambio S
0
Politrópico
Reversible
Relación p-V
PV^N=c
Relación p-V-T
P1/P2=(V2/V1)^n
W
1/1-n(P2V2-P1V1)
Q
mu+W
Cambio h
Cp(T2-T1)
Cambio u
Cv(T2-T1)
Cambio s
CvlnT2/T1+RlnV1/V2