Química Orgánica:
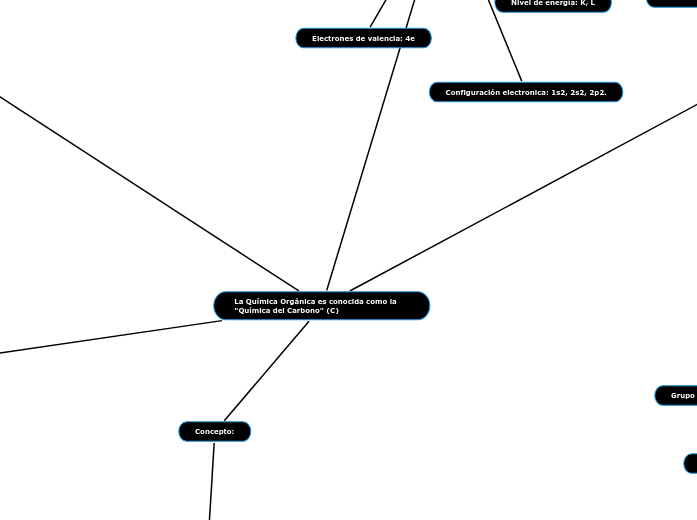
Concepto:
La Química Orgánica es conocida como la "Química del Carbono" (C)
Caracteristicas del carbono:
Símbolo en la tabla periodica: "C"
Número atómico (Z): 6
Número de protones (p): 6
Número de electrones (e): 6
Número de mas atómica: 12.0107
Familia: 14
Configuración electronica: 1s2, 2s2, 2p2.
Grupo: IV A
Nivel de energía: K, L
Periodo: 2
Electrones de valencia: 4e
Forma espacial: Tetraédrica.
Es tetravalente: 4 enlaces.
No metal.
Tipos de carbono:
Carbono primario:
Un átomo de carbono unido a otro.
C - C
Carbono secundario:
Un átomo de carbono unido a dos átomos de carbono.
C - C - C
Carbono terciario:
Un átomo de carbono unido a tres átomos de carbono.
C - C - C - C
Carbono cuaternario:
Un átomo de carbono unido a cuatro átomos de carbono.
C - C - C - C - C
Tipos de esqueletos:
Cadena abierta (acíclicos):
Insaturados:
Hay dobles o triples enlaces, rigidos y son liquidos aceitosos.
Saturados:
Son flexibles y solidos a temperatura ambiente.
Cadena cerrada (cíclica):
Homociclicos:
Solo tiene átomos de carbono se clasifican en aromaticos (con benzeno) y en alicilicos (sin benzeno).
Heterociclicos:
Cuando los ciclos presentan un átomo diferente al carbono.
Propiedades del carbono:
Concatenación:
Capacidad del átomo de carbono de unirse consigo mismo y formar distintos esquemas.
Isomería:
Misma formula molecular y diferente estructura.
Tipos de isomería:
Isomería de Cadena:
Los compuestos tienen distribuidos los átomos de carbonos de la molecula de forma diferente.
Isomería de Posición:
Los compuestos tienen las mismas funciones químicas, pero sobre átomos de carbono con números localizadores diferentes.
Isomería Funcional:
Compuestos de igual fórmula molecular que presentan funciones químicas diferentes.
Isomería Geométrica:
La presencia de la doble ligadura entre dos átomos de carbono, genera las condiciones
Alotropía:
Propiedad de los elementos en presentarse en el mismo estado de agregación y diferente estructura.
Hibridación:
Combinación de orbitales puros para formar nuevos orbitales llamados hibridos.
Tipos de compuestos:
Compuestos orgánicos:
Formado por los elementos (H, O, N, P, S, halógenos y metales) y son cerca de 13 Millones.
Estabilidad:
Son solidos, líquidos y gaseoso, muy inestables a la acción de los agentes fisicoquímicos (como el calor).
Enlaces:
Predominan los enlaces covalentes, los cuales al disolverse en solventes no polares, no conducen corriente eléctrica.
Compuestos inorgánicos:
Formado por la combinación de los 109 elementos restantes en la tabla periódica, y son cerca de 500 mil compuestos.
Estabilidad
Son solidos, mucho más resistentes al calor y acciones de agentes químicos. Se disuelven más fácilmente en agua que al ser más sencillas, tiene baja masa molecular y son reacciones muy rápidas.
Enlaces:
Predominan los compuestos iónicos o bien compuestos de moléculas polares y conducen corriente eléctrica.
Grupos Funcionales:
Hidrocarburos:
Alcanos:
Enlace sencillo: C - C
Alquenos:
Enlace doble: C = C
Alquinos:
Enlace triple: C =- C
Éter:
Formula General:
R-O-R
R: Cadena de carbonos.
Grupo Funcional:
-O-
Ester:
Grupo Funcional:
-COO
Formula General:
R-COO
R: Cadena de carbonos.
Sal organica:
Grupo Funcional:
-COO-M
Formula General:
R-COO-M
R: Cadena de carbonos.
Halógenos:
Grupo Funcional:
-X
Formula General:
R-X
R: Cadena de carbonos.
X: Cualquier elemento perteneciente a los halogenos.