Termoquímica

Ley de Hess
En reacción
Δ H
Depende
Estado inicial y final
Reactivos y productos
Entalpía (H)
Funcion de estado
Cantidad de energía
En sutancia
Tipos de reacciones
Exotérmicas
Liberación
Endotérmicas
Absorción
Principio de Chatelier
Se mantiene
Condiciones del sistema

Equilibrio químico
Termodinámica
Principio cero
Primer principio
Ley de conservación de la materia
Energía
Transferencia
Segundo principio
Tercer principio
Relación
Trabajo
Calor
Intercambio
Energia térmica
Mediante sistemas
es
Estudio
Cambios energéticos
en
Sistemas químicos y su exterior

Sistema abierto
Sí lo hay
Sí lo hay
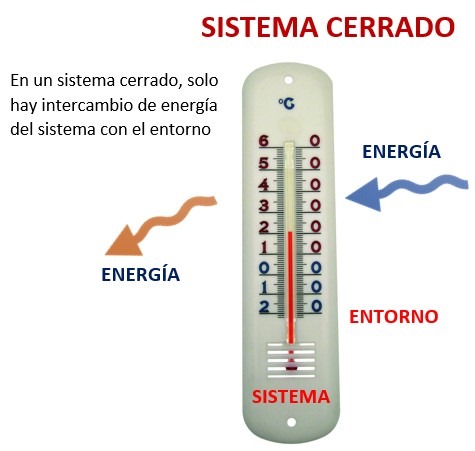
Sistema cerrado
Si lo hay
No lo hay
¿Existe intercambio con entorno?
Energía
Materia
DE
H de productos < H de los reactantes
H de productos> H de los reactivos
Las proporciones
Reactivos y productos
Minimizan alteracion
Alteración
Estado
Sin cambios
Concentración
Reactivos
Productos

Reacciones reversibles
Ej. N2(g) + 3H2(s) ↔ 2NH3(g)

Ley de acción de masas
Temperatura constante
Relación
Reactivos
Productos
Es constante
La velocidad de reacción
Cantidad
Sustancia
Tiempo