Aminoácidos, péptidos
y proteínas
Péptidos
Muchos péptidos poseen actividades biológicas, como las siguientes
Oxido-Reguladores
Glutatión: Reduce los radicales libres
Antibióticos
Los péptidos que presentan esta actividad poseen generalmente AA con configuración D o enlaces poco comunes
Es el lóbulo posterior de la hipófisis se produce un cierto número de péptidos con funciones hormonales
Angiotensina: 8 a 10 AA, enzimas sobre proteínas del plasma sanguíneo
Adrenocorticotropa: De 25 a 34 aminoácidos, glándulas suprarrenales, regulación del metabolismo de carbohidratos
Oxitocina: Contracción del útero y glandula mamaria
Son menos complejas que las moléculas proteicas
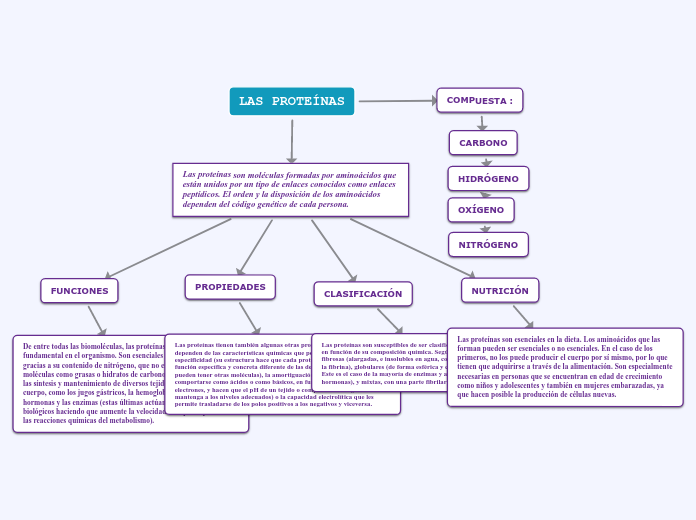
Proteínas
Organización: Niveles estructurales
Estructura cuaternaria
Razones para que exista la proteína con subunidades
Las interacciones complejas de varias subunidades sirven para regular la actividad biológica en la proteína
La síntesis de subunidades aisladas es mas eficaz que aumentar sustancialmente la longitud de una única cadena polipeptidica
Las que tienen pesos moleculares elevados están formados por varias cadenas polipeptidicas
Las subunidades es un complejo proteico, pueden ser idénticas o bastantes diferentes
Cada componente polipeptidico se denomina una subunidad
Estructura terciaria
Se estabilizan por las siguientes interacciones:
Puentes de disulfuro
Enlaces covalentes
Puentes salinos
Interacciones electrostáticas
Interacciones hidrófobas
Puentes de H
Señala las conformaciones tridimensionales únicas que asumen las proteínas globulares al plegarse en sus estructuras nativas
Las proteínas globulares suelen contener varias unidades compactadas llamadas dominios
Los dominios son segmentos estructuralmente independientes que poseen funciones especificas
Tienen un empaquetamiento eficaz al plegarse la cadena polipeptidica= proteínas globulares compactadas
El plegamiento proteico es un proceso en el que una molécula desorganizada naciente adquiere una estructura muy organizada
Estructura secundaria
Se encuentran los hélice alpha y las laminas plegadas Betas
Lamina plegada beta
Hay 2 tipos de laminas plegadas beta, paralelas y antiparalelas
Esta estabilizada por puentes de H
En lugar de estar enrollada esta totalmente extendida
cada segmento individual se denomina una cadena beta
Se forma cuando se alinean de lado 2 o mas segmentos de cadenas polipeptidicas
Hélice alpha
Los grupos R quedan hacia fuera de las hélices
Se forman puentes de H
Es una estructura rigida en forma de varilla que se forma cuando una cadena de polipeptidos se retuerce en una forma helicoidal
Consta de varios patrones repetidos de polipéptidos
Estructura primaria
Malformaciones pueden ocasionar mutaciones como:
Drepanocitosis: producida por una hemoglobulina mutante
Los polipéptidos homólogos han sido utilizados para trazar las relaciones genéticas de las distancias especificas
Las interacciones entre los residuos de AA
Cada polipéptido tiene una secuencia de AA especifica
Clasificación
De acuerdo a su composición
Proteínas conjugadas
Una molécula proteica combinada con un grupo prostéico se denomina holopróteina
Una protepina sin su grupo proteico se le denomina apoproteína
Consta de una proteína simple combinada con compuesto no proteico, que se le denomina grupo postico
Proteínas simples
Solo contienen aminoácidos
De acuerdo a su forma
Proteínas globulares
Tienen funciones dinámicas
Ej: Enzimas, himonoglobulinas, proteínas de transporte
Proteínas fibrosas
Tienen funciones estructurales y protectoras/insolubles en agua
Ej: Queratina del pelo, uña y piel
Funciones
Sirven prácticamente para todo en los seres vivos, tareas como las siguientes:
Respuesta a las agresiones
Respuesta a agresores abióticos, están mediadas por determinadas proteínas
Metalotioneína: se une a metales tóxicos
como el Cd Ag, Au y los secuestra
Citocromo p450: Convierte contaminantes
orgánicos tóxicos a menos tóxicos
Almacenamiento
Reserva de nutrientes esenciales
Caseina: Leche de los mamíferos
Ovoalbúmina: Nuevo de aves
Transporte
Pueden actuar como transportadoras de otras moléculas o iones a través de las membranas o entre células
Transportador de glucosa
Bomba Na/K
Regulación
La unión de una molécula hormonal o un factor de crecimiento a receptores en sus células blanco, modificando la función celular, tal como:
Factores de crecimiento y su hormona
Insulina y glucosa
Defensa
Una extensa variedad de proteínas son protectoras, tales como
Queratina, fibrinogeno y trombina, inmunoglobulinas
Movimiento
Actina y tubulina que forman el citoesqueleto la cual participa en división celular, endocitosis y exositosis.
EN todos los movimientos celulares
Suelen tener propiedades muy especializadas como:
Elastina: Vasos sanguíneos en la piel
Colágeno: componente principal de los tejidos conjuntivos
Algunas proporcionan protección y sostén
Catálisis
Pueden aumentar la velocidad de reacción por factores entre 10 y 12
Las enzimas son un grupo de proteínas que dirigen y aceleran miles de reacciones bioquímicas en procesos como la digestión
Se considera que cuando un péptido sobrepasa los 40-50 AA tenemos una cadena polipeptidica que llamamos proteína
Son polímeros con mayor grado de complejidad
Aminoácidos
Reacciones de los aminoácidos
Tienen numerosas reacciones, tales como:
Puentes disulfuro
El S se encuentra en los grupos R de los aminoácidos
El grupo sulfhidrilo de la cisteína es muy reactivo
Oxidación de la cisteína
Encale peptídico
En esta reacción se pierde una molécula de agua
Es el resultado de la unión de aminoácidos, cuando el grupo carboxilo de un aminoácido reacciona con el grupo amino de otro
Son polimeras lineales formadas por aminoácidos
unidos por este tipo de enlaces
Aminoácidos modificados
Quiralidad
Las proteasas, enzimas que degradan proteínas por
hidrólisis de los enlaces peptídicos
No pueden degradar polipéptidos artificiales formados por aminoácidos D
Si las proteínas tienen aminoácidos
D y L estas serán anormal
Las enzimas son moléculas quirales
Solo pueden unir molécula de sustrato en una forma
enantiómera
Estereoisómeros de los aminoácidos
Con pocas excepciones, en las proteínas solo se encuentran los aminoácidos L
Los C alpha son asimetriscos / Con centros quirales
Aminoácidos con actividad biológica
Los aminoácidos cumplen funciones
no proteicas tales como:
Intermediarios metabólicos
Ornitina
Citrulina
Argina
Precursores
Clorofila
Las bases nitrogenadas
De moléculas con N
Mensajeros químicos
Hormonas
Tiroxina
Serotonina
Neurotransmisores
Aminoácidos esenciales y no esenciales
Los seres humanos y otros mamíferos no podemos
sintetizar todos los aminoácidos, por lo que lleva
a lo siguiente
Esenciales
Son aquellos que no podemos sintetizar
No esenciales
Son aquellos que si los podemos sintetizar
Clases de aminoácidos
De acuerdo con su capacidad para
interaccionar con el agua, se distinguen en 4
Aminoácidos básicos
Pueden formar enlaces iónicos con los
aminoácidos ácidos
A pH fisiológico llevan una carga positiva
Aminoácidos ácidos
Ácido aspártico > Aspartato
A pH fisiológico
En sus grupos R son carboxilos
Aminoácidos polares neutros
Son polares o hidrofobos
Interactuan fácilmente con el agua
Capaces de formar puentes de H
Aminoácidos apolares neutros
Son hidrofobos
Interaccionan muy poco con el agua
Estos grupos R no llevan cargas + o -
Sus grupos R son hidrocarburos
Propiedades generales
EL grupo R proporciona a cada aminoácido sus propiedades singulares
Las moléculas neutras
Que llevan un número igual de cargas positivas
y negativas de forma simultánea se denominan
Zwitteriones
Tienen generalmente un pH de 7
Cada aminoácidos puede considerarse un ácido o como una base, "Anfótero" o "Anfólito"
Aminoácidos no estandar
Son los que se encuentran en los seres vivos pero
no en sus proteínas
Son residuos de aminoácidos que se han modificado
de forma química despues de haberse incorporado
a un polipéptido
Aminoácidos estándar
Son los 20 aminoácidos que se encuentran habitualmente
en las proteínas
También conocidos como proteinogénicos
Estructura
Esta conformado de la siguiente manera:
Subtema
Introducción
Existen posibilidades infinitas para
crear proteínas
Proteoma= Todo conjunto de proteínas
Las proteínas surgen de la unión de aminoácidos
Las proteínas son constituyentes
esenciales de todos los organismos
El genoma humano contiene unos 30000 genes
codificadores para proteínas
La mayoría de las tareas que realizan las
células requieren proteínas
Pérdida de estructura proteica
Desnaturalización
Tipos de desnaturalización
Cambios de temperatura
AL aumentar la temperatura aumenta la velocidad de vibración de las moléculas y rompe las interacciones débiles como los enlaces de H
Agresión mecánica
las acciones de agitación y trituración rompen el delicado equilibrio de fuerzas que mantiene la estructura proteica
Iones metálicos pesados
Metales pesados como el mercurio y el plomo rompen los puentes salinos y forman enlaces con los grupos sulfhidrilos
Concentración salina
Afecta los puentes salinos en la estructura de la proteína
Agentes reductores
Beta-mercaptoetanol: convierten los puentes de disulfuros en grupos sulfhidrilos
Detergentes
Son moléculas anfipáticas, rompen las interacciones hidrófobas, haciendo que se desplieguen las proteínas en cadenas polipeptidicas extendidas
Disolventes orgánicos
Los disolventes orgánicos hidrosolubles, como el etanol,interfieren con las interacciones hidrofobas
Ácidos y bases fuertes
Los cambios de pH dan lugar a la protonación de algunos grupos letales de la proteína, lo cual altera los patrones de enlace del H y los puentes salinos
La hay reversible o irreversible
El proceso de perdida/destrucción de la estructura nativa
La estructura proteica sea específicamente sensible a los factores del entorno
Muchos agentes fisicos y quimicos pueden romper la conformación nativa de una proteína