af Abraham Parra 4 år siden
635
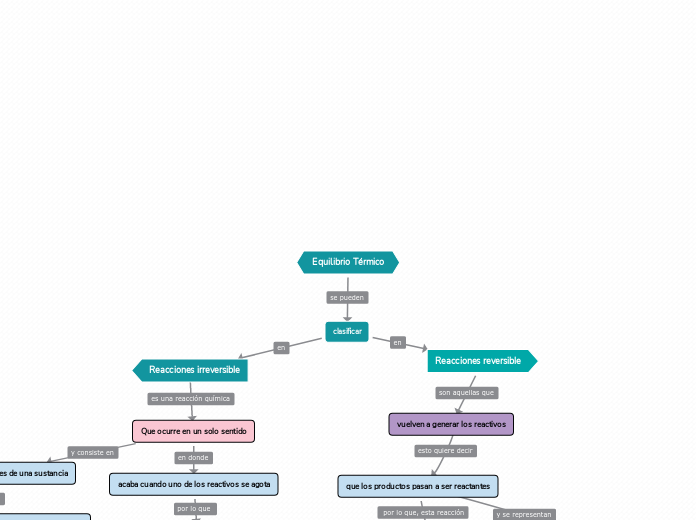
Equilibrio Térmico
Las reacciones químicas pueden clasificarse en reversibles e irreversibles según su capacidad de retornar a los reactivos originales. Las reacciones reversibles, como la interacción entre ácido y base débil, permiten que los productos puedan transformarse nuevamente en reactivos si se cambia el sentido de la reacción.