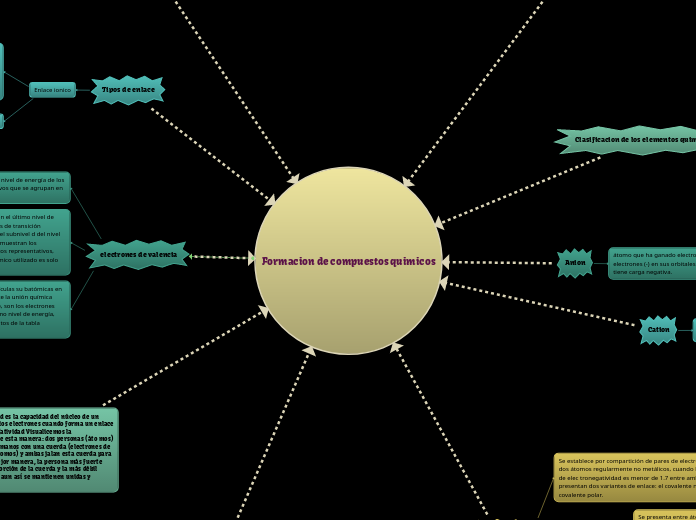
Formacion de compuestos quimicos
Elace quimico
A lo largo del texto hemos hablado del enlace químico como si fuera un viejo conocido, pero no hemos ahondado en sus características. Como ya mencionamos fel enlace químico es la unión química entre dos o más áto mos, iguales o diferentes La mayoría de los átomos no existen solos, de ma nera aislada, pues son muy inestables, excepto los de los elementos llamados gases nobles, que se encuentran en el grupo VIIIA de la tabla.
La electronegatividad es la capacidad del núcleo de un átomo para atraer a los electrones cuando forma un enlace químico. (Electronegatividad Visualicemos la electronegatividad de esta manera: dos personas (áto mos) están unidas por las manos con una cuerda (electrones de valencia de ambos átomos) y ambas jalan esta cuerda para poder caminar de mejor manera, la persona más fuerte podrá tener mayor porción de la cuerda y la más débil menor porción, pero aun así se mantienen unidas y caminan juntas.
Electronegatividad
electrones de valencia
Los electrones de valencia son las partículas su batómicas en las que más atención ponemos du rante la unión química entre dos o más átomos Generalmente, son los electrones que se encuen tran ubicados en el último nivel de energía, pero no ocurre así en todos los elementos de la tabla periódica.
son los electrones que se encuentran en el último nivel de energía de los átomos de los elementos de transición sumados a algunos de los electrones del subnivel d del nivel energético anterior) En la figura 4.4 se muestran los electrones de valencia de tres elemen tos representativos, teniendo en cuenta que el modelo atómico utilizado es solo para visualizar el concepto.
Electrones de valencia de elementos de trancicion
son los que se encuentran en el último nivel de energía de los átomos de los elementos repre sentativos que se agrupan en la tabla periódica.
Electrones de valencia de elementos representativos
Tipos de enlace
Enlace ionico
Enlace metalico
Este enlace es un caso especial. Los átomos de diferentes metales no se enlazan químicamente, es decir, no existen compuestos quí micos formados por metales diferentes.
Este tipo de enlace se establece por transferencia de elec trones, normalmente entre un metal y un no metal, cuando la diferencia de electronegatividades es mayor de 1.7, Por ejemplo, en el cloruro de sodio, NaCl, donde la diferencia es de 2.1. Todos los metales de los grupos IA y IIA con los no metales de los grupos VIA y VIIA forman este tipo de enlace.
IUPAC
(Unión Internacional de Química Pura y Aplicada, por sus si glas en inglés) surgió como organización en 1919. Químicos de sectores como la industria y de las universidades reconocieron la necesidad de establecer estándares globales en la simbología y protocolos operacionales para la Química. La normalización de las masas, las medidas, los nombres y símbolos de elementos y sustancias era esencial para el éxito continuo de la empresa científica y para el desarrollo de las investigaciones y del inter cambio internacional.
Enlace covalente
Covalente polar
Covalente no polar
Se presenta cuando la diferencia de electronegativi dades es menor de 1.7, pero mayor de 0.5, Por ejemplo, el HCl, cuya diferencia entre el hidrógeno y el cloro es de 0.9.
Se presenta entre átomos de un mismo elemento, donde la diferencia sería cero; o entre átomos de elementos diferentes, pero con electronegatividades muy cercanas, de tal forma que la dife rencia es menor que 0.5, Es el caso de moléculas diatómicas como el H y el O, y de algunos compuestos como el metano (CH,), donde la dife rencia de electronegatividad entre el carbono y el hidrógeno es de 0.4.
Se establece por compartición de pares de electrones entre dos átomos regularmente no metálicos, cuando la diferencia de elec tronegatividad es menor de 1.7 entre ambos. Se presentan dos variantes de enlace: el covalente no polar y el covalente polar.
Cation
átomo que ha perdido sus electrones de valencia posee más protones (+) en su núcleo sus orbitales, y tiene carga positiva
Anion
átomo que ha ganado electrones de valencia y posee más electrones (-) en sus orbitales que protones (+) ens núcleo, y tiene carga negativa.
Clasificacion de los elementos quimicos
Se clasifican a su vez en actínidos, lantánidos, metales de transición, alcalinos, alcalino-térreos y otros metales. No metales. Son elementos que no son buenos conductores de calor ni de electricidad y son demasiado débiles para poder laminarse o estirarse como ocurre con los metales.
Clasificacion deacuerdo con su funcion quimica
oxidos
Acidos
Bases
son compuestos formados por la combinación química de un metal y al menos un no metal, unidos mediante un enlace iónico Pueden ser se les binarias integradas por un metal y un no metal, por ejemplo: LiBr, Bas KCl; sales ternarias, que están formadas por un metal y dos no metales, in cluido el oxígeno, llamadas también oxisales, por ejemplo: KNO,, Na 50 CaCO. Las cuaternarias o poliatómicas están compuestas por al menos un metal y otros no metales, por ejemplo: KSCN, LIHCO,₁,BaH,PO
son sustancias que contienen al ion hidrógeno como catión (H y lo liberan en contacto con el agua formando soluciones ácidas Los más comunes son los hidrácidos y los oxiácidos. Los hidrácidos son ácidos binarios formados por hidrógeno y un no metal, por ejemplo: HCl, HBr, HF. Los oxiácidos son ácidos ternarios formados por hidrógeno, un no metal y ox geno, por ejemplo: HNO, H₂SO,, HCO,.
son compuestos binarios formados por la combinación de un ele mento con oxígeno. Si el oxígeno se combina con un metal es un óxido metálico, por ejemplo: Na,O, CaO, ALO. Si se combina con un no metal es un óxido no metálico, por ejemplo: CO, SO, NO,. En cualquier caso, el oxígeno siempre es el anión divalente O² y se le denomina óxido.